Conceptos básicos de estequiometría
Summary
TLDREn este vídeo, Fabián explica la importancia de la espectrometría en la química y su aplicación diaria. Detalla cómo se utiliza para medir proporciones exactas de materia prima en la industria y en la vida cotidiana, como en la construcción de una casa o la elaboración de refrescos. Aborda conceptos fundamentales como moles, masa molar, masa molecular y el número de Avogadro, utilizando ejemplos sencillos para su comprensión. Finalmente, motiva a los estudiantes a practicar y dedicarse para lograr éxito en la vida.
Takeaways
- 🔬 La espectrometría es una técnica utilizada para determinar la cantidad de materia prima necesaria en una reacción química, evitando desperdicios.
- 🏗️ La química y la cantidad adecuada de reactivos son fundamentales en la construcción, como en la mezcla correcta de cemento para asegurar la estabilidad de una estructura.
- 🍇 En la vida cotidiana, la química se aplica en la producción de alimentos y bebidas, donde los ingredientes se combinan en proporciones específicas para obtener productos de buena calidad.
- 🧪 El concepto de mol es una unidad de medida en química que representa la cantidad de sustancias que contienen un número fijo de partículas elementales, equivalente a los átomos en 12 gramos de carbono-12.
- 🔢 El número de Avogadro (6.022 x 10^23) indica el número de partículas elementales en un mol de cualquier sustancia, independientemente de su masa o tamaño.
- 🥚 La analogía de la docena de huevos ayuda a entender el concepto de mol, donde tanto una docena de huevos de gallina como de avestruz tienen 12 unidades, aunque su masa sea diferente.
- ⚖️ La masa molar es la masa en gramos de un mol de una sustancia, y se determina a partir de las masas atómicas que se encuentran en la tabla periódica.
- 🌐 La masa atómica, que se encuentra debajo del símbolo de un elemento en la tabla periódica, es equivalente a la masa molar de ese elemento.
- 🍬 La masa molecular de una molécula, como la glucosa, se calcula sumando las masas atómicas de todos los átomos que la componen, multiplicadas por su respectiva cantidad en la fórmula química.
- 📚 La práctica y la dedicación son claves para el éxito en la química, ya que la teoría solo es útil si se aplica y se practica en la resolución de problemas reales.
Q & A
¿Qué es la espectrometría y para qué se utiliza?
-La espectrometría es una técnica que se utiliza para calcular la cantidad de materia prima necesaria para producir un producto sin generar desperdicio de material. Se aplica tanto en las industrias como en la vida cotidiana.
¿Cómo se relaciona la espectrometría con la construcción de una casa?
-En la construcción de una casa, la espectrometría se relaciona con la necesidad de mezclar el cemento en proporciones adecuadas para asegurar la estabilidad de las paredes, evitando su colapso si las proporciones son incorrectas.
¿Qué es el número de Avogadro y cuál es su significado en la química?
-El número de Avogadro es un valor numérico que representa el número de partículas elementales (átomos, moléculas, iones) en un molde de cualquier sustancia, que es aproximadamente 6.022 x 10^23.
¿Qué es la masa molar y cómo se determina?
-La masa molar es la masa de un mol de una sustancia, expresada en gramos o kilogramos. Se determina a partir de las masas atómicas de los elementos, que se encuentran en la tabla periódica.
¿Cuál es la masa molar del hidrógeno y del carbono según la tabla periódica?
-La masa molar del hidrógeno es de aproximadamente 1 gramo, mientras que la del carbono es de 12 gramos.
¿Qué es la masa molecular y cómo se calcula?
-La masa molecular es la suma de las masas atómicas de todos los átomos que componen una molécula. Se calcula multiplicando la masa atómica de cada elemento por su cantidad en la molécula y sumando los resultados.
¿Cuál es la masa molecular de una molécula de glucosa?
-La masa molecular de una molécula de glucosa es de 180 gramos, basado en la suma de las masas atómicas de sus átomos de carbono (12), hidrógeno (1) y oxígeno (16).
¿Cómo se relaciona la masa molecular con la masa molar de una sustancia?
-La masa molecular de una sustancia es igual a su masa molar, ya que ambas medidas representan la masa de un mol de la sustancia, pero la masa molar se expresa en gramos o kilogramos.
¿Por qué es importante el concepto de mol en la química?
-El concepto de mol es importante en la química porque permite medir y comparar cantidades de sustancias de manera estándar, facilitando el cálculo de reacciones químicas y la producción de productos.
¿Cómo se relacionan las proporciones adecuadas de reactivos con la calidad del producto final, como en el caso del refresco de moras?
-Las proporciones adecuadas de reactivos son fundamentales para garantizar la calidad óptima del producto final, ya que afectan directamente a la textura, sabor y apariencia del mismo, como en el caso del refresco de moras.
Outlines

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraMindmap

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraKeywords

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraHighlights

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraTranscripts

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraVer Más Videos Relacionados

U I Materia

La electricidad, conceptos básicos - Sistemas tecnológicos 1°

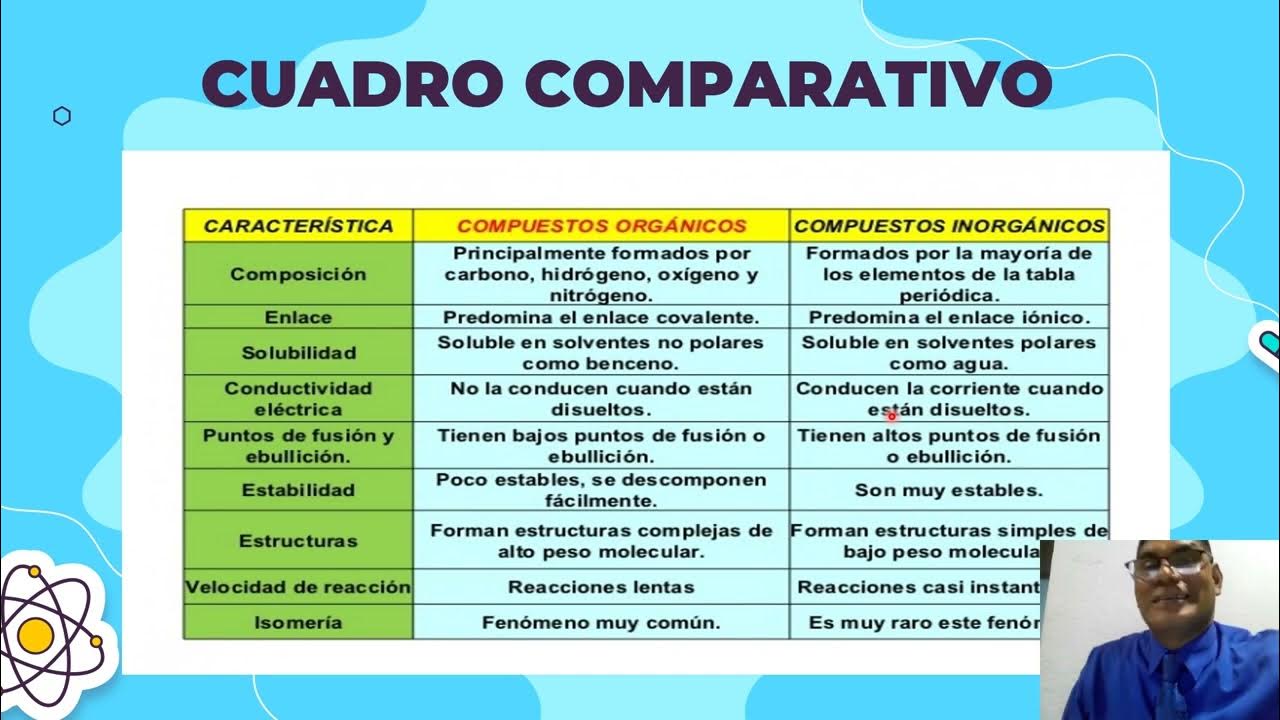
Introducción a la QUÍMICA ORGÁNICA | Compuestos orgánicos vs inorgánicos 🤼

ACIDOS CARBOXILICOS. COMO NOMBRAR ÁCIDOS CARBOXILICOS. NOMENCLATURA DE ÁCIDOS CARBOXILICOS

[Química] 🧠NÚMEROS CUANTICOS.🔠 Explicación FACIL. Configuración electrónica.

Cuestiones sobre Software | | UPV
Clase quimica organica 1
5.0 / 5 (0 votes)