Conjugate Acid Base Pairs, Arrhenius, Bronsted Lowry and Lewis Definition - Chemistry
Summary
TLDREn este video se exploran las definiciones de ácidos y bases según los enfoques de Arrhenius, Brønsted-Lowry y Lewis. Se explica que los ácidos de Arrhenius liberan iones H⁺ en solución, mientras que las bases liberan iones OH⁻. Según Brønsted-Lowry, los ácidos son donantes de protones y las bases aceptores de protones. Además, se presentan ejemplos de pares ácido-base conjugados y se detalla la definición de ácidos y bases de Lewis, donde los ácidos aceptan pares de electrones y las bases los donan. Se incluyen ejemplos prácticos para ilustrar cada concepto.
Takeaways
- 😀 La definición de Arrhenius establece que los ácidos liberan iones H⁺ en solución, mientras que las bases liberan iones OH⁻.
- 😀 Los ácidos de Arrhenius incluyen ejemplos como el ácido clorhídrico (HCl) y el ácido sulfúrico (H₂SO₄).
- 😀 Los ejemplos de bases de Arrhenius incluyen hidróxido de sodio (NaOH) y hidróxido de potasio (KOH).
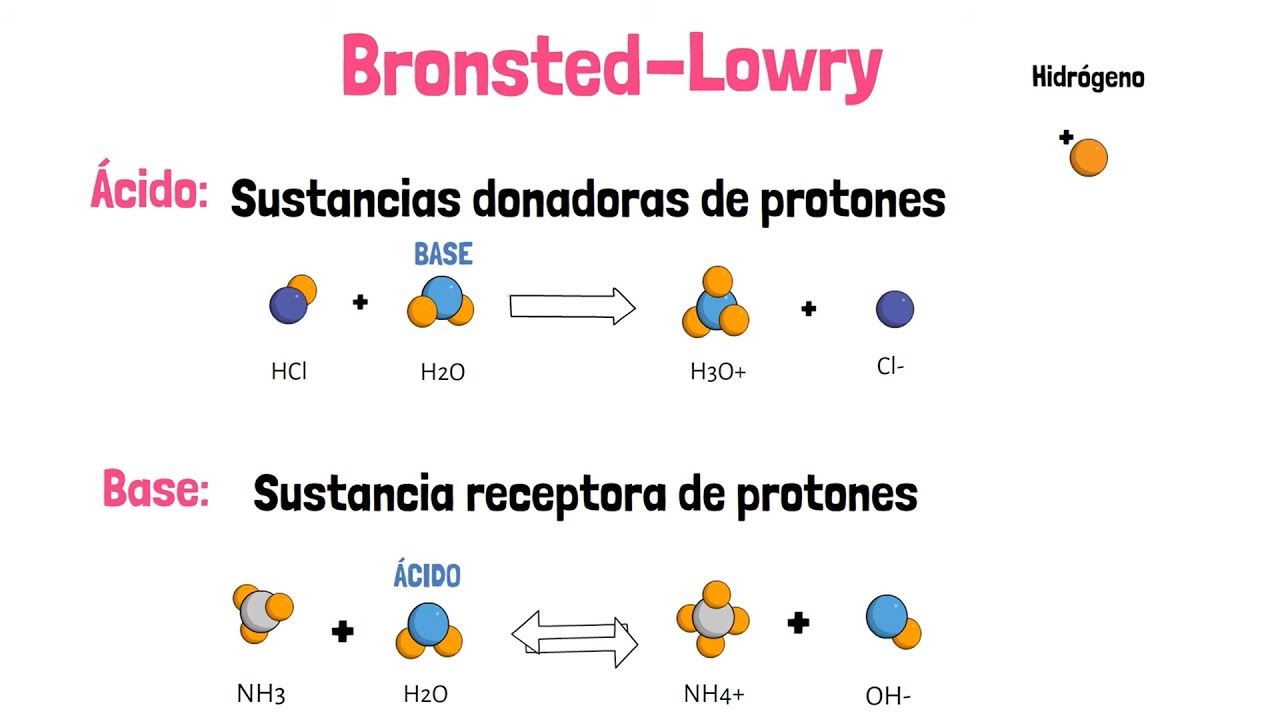
- 😀 La definición de Brønsted-Lowry describe los ácidos como donantes de protones (H⁺) y las bases como aceptores de protones.
- 😀 En la reacción entre HF y agua, HF actúa como ácido de Brønsted y agua como base de Brønsted.
- 😀 Los pares ácido-base conjugados se forman cuando un ácido dona un protón y una base acepta uno.
- 😀 La definición de Lewis describe los ácidos como aceptores de pares de electrones y las bases como donantes de pares de electrones.
- 😀 En la reacción entre BH₃ y NH₃, NH₃ actúa como base de Lewis y BH₃ como ácido de Lewis.
- 😀 El ion bicarbonato (HCO₃⁻) puede formar su ácido conjugado (H₂CO₃) y su base conjugada (CO₃²⁻).
- 😀 Comprender estas definiciones es esencial para el estudio de la química y las interacciones entre diferentes sustancias.
Q & A
¿Cuál es la definición de ácidos según la teoría de Arrhenius?
-Según la teoría de Arrhenius, los ácidos son sustancias que liberan iones H+ o iones hidronio (H3O+) en solución.
¿Qué caracteriza a las bases según la definición de Arrhenius?
-Las bases, según Arrhenius, son sustancias que liberan iones hidróxido (OH-) en solución.
¿Qué ejemplos se dan de ácidos Arrhenius en el video?
-Los ejemplos de ácidos Arrhenius incluyen el ácido fluorhídrico (HF), ácido clorhídrico (HCl), ácido sulfúrico (H2SO4) y ácido nítrico (HNO3).
¿Qué significa que un ácido sea un donador de protones en la teoría de Brønsted-Lowry?
-En la teoría de Brønsted-Lowry, un ácido es un donador de protones (H+), lo que significa que puede ceder un ion de hidrógeno a otra sustancia.
¿Cómo se determina el ácido conjugado y la base conjugada en una reacción?
-El ácido conjugado se forma al añadir un protón (H+) a una molécula, mientras que la base conjugada se forma al quitar un protón.
¿Qué papel juega el agua en las reacciones ácido-base según la teoría de Brønsted-Lowry?
-El agua puede actuar como un donador de protones (ácido) o como un aceptador de protones (base), dependiendo de la reacción.
¿Qué es un ácido y una base según la teoría de Lewis?
-Según la teoría de Lewis, un ácido es un aceptador de pares de electrones y una base es un donador de pares de electrones.
¿Cuál es un ejemplo de una reacción ácido-base según la teoría de Lewis?
-Un ejemplo es la reacción entre Boro (BH3) y el amoníaco (NH3), donde el nitrógeno del amoníaco dona un par de electrones al boro.
¿Qué ocurre con la carga formal de los átomos en la reacción de Lewis entre BH3 y NH3?
-En esta reacción, el nitrógeno adquiere una carga formal positiva y el boro una carga formal negativa, pero el compuesto resultante es neutral.
¿Cómo se relacionan los conceptos de ácido y base en las diferentes teorías discutidas?
-Las diferentes teorías definen ácidos y bases a través de la transferencia de protones o electrones, cada una proporcionando una perspectiva única sobre cómo se comportan en reacciones químicas.
Outlines

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraMindmap

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraKeywords

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraHighlights

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraTranscripts

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraVer Más Videos Relacionados

[Química] Teorías🧠 Acido-bases Arrhenius, Brönsted-Lowry, Lewis

¿Qué son los ácidos y las bases?: La mejor explicación

14-Equilibrios Ácido-Base. 1.0 Definiciones de Arrhenius, Bronsted-Lowry y Lewis.

Teorías ácido - base (Arrhenius, Bronsted-Lowry, Lewis)
Ácidos y Bases de Arrhenius y Bronsted

Definiciones de ácido-base

⚠️Teorías Ácido-Base | Arrhenius, Bronsted-Lowry, Lewis⚠️ [Fácil y Rápido] | QUÍMICA |
5.0 / 5 (0 votes)