[Química] Teorías🧠 Acido-bases Arrhenius, Brönsted-Lowry, Lewis
Summary
TLDREn este video se profundiza en las teorías químicas que explican qué son los ácidos y las bases. Se abordan las teorías de Arrhenius, Bronsted-Lowry y Lewis, destacando sus diferencias y aplicaciones. Arrhenius definió los ácidos como sustancias que generan iones hidrógeno en agua, mientras que Bronsted-Lowry introdujo la idea de transferencia de protones. Lewis, por su parte, definió los ácidos como sustancias que aceptan pares de electrones. A través de estos enfoques, el video ayuda a comprender cómo reconocer e identificar ácidos y bases en diversas situaciones químicas.
Takeaways
- 😀 La química es una ciencia relativamente nueva, surgida en el siglo XVII, con importantes contribuciones de científicos como Robert Boyle y Antoine Lavoisier.
- 😀 Los ácidos y bases fueron estudiados formalmente a partir de la química, y aunque ya se utilizaban históricamente, no fue hasta el surgimiento de esta disciplina que se comprendieron sus propiedades y comportamientos.
- 😀 La teoría de Arrhenius establece que los ácidos generan iones hidrógeno (H+) y las bases generan iones hidróxido (OH-) al disolverse en agua.
- 😀 Según Arrhenius, los ácidos y bases pueden ser identificados por la liberación de estos iones en soluciones acuosas, lo que explica fenómenos como la neutralización y formación de sales.
- 😀 A pesar de su importancia, la teoría de Arrhenius tiene limitaciones, ya que no todos los ácidos y bases se disuelven en agua, y algunas bases no contienen OH-.
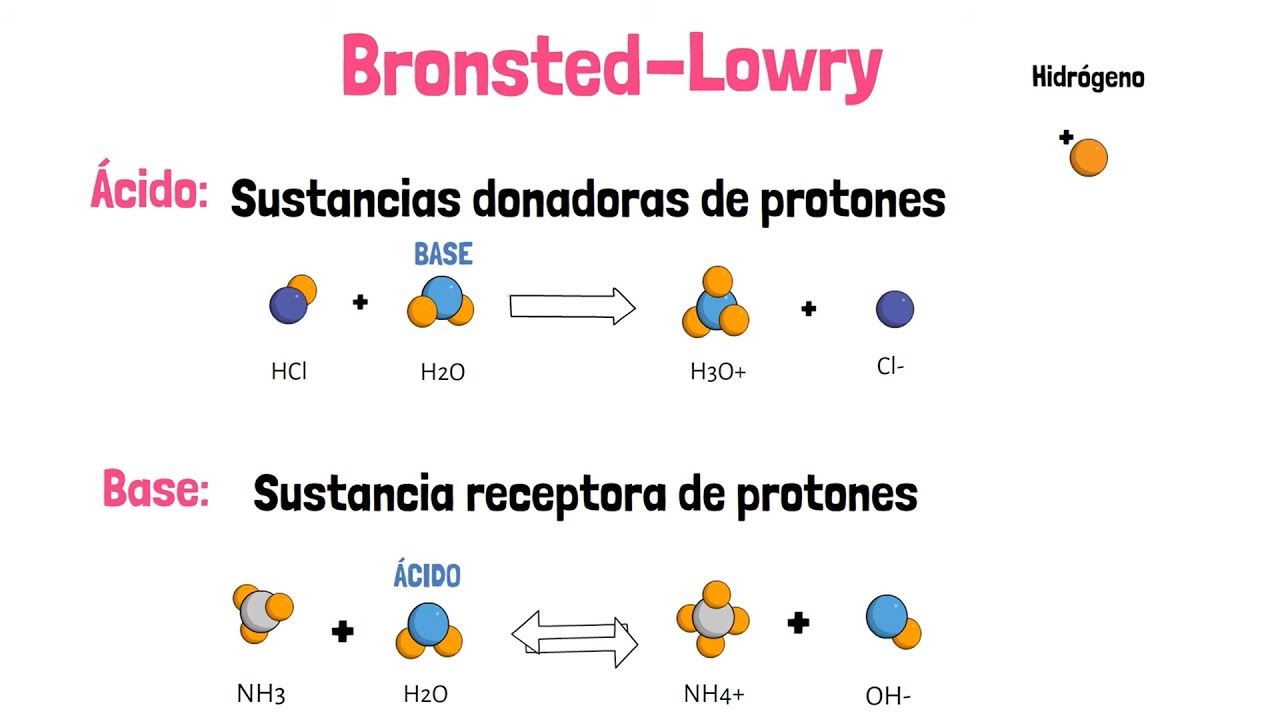
- 😀 La teoría de Brønsted-Lowry introduce el concepto de transferencia de protones (H+), donde los ácidos son donadores de protones y las bases son aceptores de protones.
- 😀 La teoría de Brønsted-Lowry es más completa que la de Arrhenius, ya que explica fenómenos fuera del contexto acuoso y no requiere necesariamente la presencia de agua.
- 😀 El concepto de ácidos y bases conjugados es fundamental en la teoría de Brønsted-Lowry, donde el ácido pierde un protón y se convierte en una base conjugada, y viceversa.
- 😀 La teoría de Lewis redefine los ácidos y bases como sustancias que aceptan o donan pares de electrones. Los ácidos de Lewis son capaces de aceptar un par de electrones, mientras que las bases los ceden.
- 😀 La teoría de Lewis es más general que las teorías anteriores y abarca más tipos de reacciones ácido-base, permitiendo identificar sustancias que no contienen hidrógeno pero que actúan como ácidos o bases.
- 😀 A pesar de sus ventajas, la teoría de Lewis también presenta limitaciones, ya que no explica todos los mecanismos de reacciones ácido-base, como la formación de hidrógeno a partir de reacciones con metales.
Q & A
¿Qué son los ácidos y las bases según la teoría de Arrhenius?
-Según la teoría de Arrhenius, los ácidos son sustancias que al disolverse en agua generan iones hidrógeno (H⁺), mientras que las bases generan iones hidróxido (OH⁻).
¿Cuáles son las limitaciones de la teoría de Arrhenius?
-La teoría de Arrhenius tiene limitaciones como no poder explicar los ácidos que no se disuelven en agua o las bases que no contienen iones OH⁻. Además, solo se aplica a reacciones en soluciones acuosas.
¿Qué es la teoría de Brønsted-Lowry y cómo mejora la de Arrhenius?
-La teoría de Brønsted-Lowry afirma que los ácidos son donadores de protones y las bases aceptadores de protones. Esta teoría es más completa porque no necesita agua como solvente y explica mejor los comportamientos ácido-base en solventes diferentes.
¿Qué significa que un ácido sea fuerte o débil según la teoría de Brønsted-Lowry?
-Según la teoría de Brønsted-Lowry, un ácido fuerte es aquel que pierde un protón fácilmente, mientras que un ácido débil pierde un protón con dificultad.
¿Cómo funciona la transferencia de protones en la teoría de Brønsted-Lowry?
-En la teoría de Brønsted-Lowry, los ácidos ceden protones (H⁺), que son aceptados por las bases. Al transferir el protón, el ácido se convierte en su base conjugada, y la base se convierte en su ácido conjugado.
¿Qué es un ácido y una base conjugados según Brønsted-Lowry?
-Un ácido conjugado es la sustancia que resulta cuando un ácido pierde un protón, mientras que una base conjugada es la sustancia que resulta cuando una base acepta un protón.
¿Cómo se comporta el agua en una reacción ácido-base según Brønsted-Lowry?
-El agua puede actuar como un ácido o como una base dependiendo de la reacción. Si acepta un protón, actúa como base; si lo cede, actúa como ácido.
¿Qué aportó la teoría de Lewis sobre los ácidos y bases?
-La teoría de Lewis definió los ácidos como sustancias capaces de aceptar un par de electrones y las bases como sustancias que pueden ceder un par de electrones. Esta teoría es más amplia porque explica una gama más amplia de reacciones ácido-base, no solo las que involucran protones.
¿En qué se diferencia la teoría de Lewis de las teorías de Arrhenius y Brønsted-Lowry?
-La teoría de Lewis se diferencia porque se enfoca en la transferencia de electrones, mientras que las teorías de Arrhenius y Brønsted-Lowry se centran en la transferencia de protones. Lewis abarca más reacciones y permite identificar ácidos y bases que no son cubiertos por las otras teorías.
¿Cuáles son los beneficios de usar la teoría de Lewis en comparación con las teorías anteriores?
-La teoría de Lewis es más flexible, ya que permite explicar reacciones ácido-base entre compuestos que no involucran protones y también incluye ácidos y bases que no siguen las definiciones de Arrhenius o Brønsted-Lowry, ampliando su aplicabilidad a más sustancias y reacciones.
Outlines

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowMindmap

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowKeywords

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowHighlights

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowTranscripts

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowBrowse More Related Video

Teorías ácido - base (Arrhenius, Bronsted-Lowry, Lewis)

1.14 Compuestos inorgánicos

⚠️Ácidos y Bases: ¿Qué son? Características y Ejemplos⚠️ [Fácil y Rápido] | QUÍMICA |
Ácidos y Bases de Arrhenius y Bronsted

Tema VII. V04 Propiedades químicas de ácidos carboxílicos y derivados

¿Qué son y CÓMO IDENTIFICARLOS?
5.0 / 5 (0 votes)
