QUIMICA NOVENO SEMANA 1 FINAL
Summary
TLDREn esta clase de química, se explica la formación y formulación de óxidos, incluyendo óxidos básicos y ácidos. Se aborda cómo el oxígeno siempre trabaja con un estado de oxidación -2 y cómo interactúa con metales o no metales para formar compuestos. A través de ejemplos prácticos, se muestra cómo determinar los estados de oxidación de los elementos y cómo intercambiar sus subíndices para crear fórmulas químicas. También se incluyen ejercicios prácticos, seguidos de una pausa activa para estiramiento y relajación, ayudando a los estudiantes a despejarse antes de continuar con el aprendizaje.
Takeaways
- 😀 El hierro se oxida cuando entra en contacto con oxígeno y humedad, formando óxido de hierro, un proceso llamado oxidación.
- 😀 Los óxidos pueden ser básicos (cuando un metal se combina con oxígeno) o ácidos (cuando un no metal se combina con oxígeno).
- 😀 En los óxidos, el oxígeno siempre tiene un estado de oxidación de -2.
- 😀 Los metales en los óxidos pueden tener varios estados de oxidación, lo que es esencial para la correcta formulación del compuesto.
- 😀 Para formular un óxido básico, se intercalan los números de oxidación del metal y el oxígeno en los subíndices de la fórmula química.
- 😀 En el caso del óxido de potasio, la fórmula K2O se forma debido a que el potasio tiene un estado de oxidación +1 y el oxígeno siempre es -2.
- 😀 El óxido de hierro se puede simplificar a FeO cuando se intercambian los estados de oxidación y se simplifican los subíndices, si es posible.
- 😀 Los óxidos ácidos, también llamados anhídridos, se forman cuando un no metal se combina con oxígeno, y estos tienen enlaces covalentes.
- 😀 En los óxidos ácidos, como el óxido de cloro (Cl2O), el cloro tiene un estado de oxidación +1 y el oxígeno siempre es -2.
- 😀 Es crucial entender y aplicar correctamente los estados de oxidación para formular correctamente óxidos y nombrarlos adecuadamente.
Q & A
¿Qué es la oxidación y cómo afecta al hierro?
-La oxidación es un proceso químico que ocurre cuando el hierro entra en contacto con el oxígeno del aire y la humedad. Este proceso forma una capa de óxido de hierro, también conocido como óxido rojo o óxido de hierro (III), lo que provoca que el hierro pierda su brillo y se deteriore con el tiempo.
¿Cuáles son los cinco términos clave mencionados al inicio de la clase?
-Los cinco términos clave son óxidos, estados de oxidación, oxígeno, metales y no metales.
¿Qué son los óxidos y cómo se clasifican?
-Los óxidos son compuestos binarios formados por la unión de un elemento con oxígeno. Se clasifican en óxidos básicos, cuando el oxígeno se une con un metal, y óxidos ácidos, cuando el oxígeno se une con un no metal.
¿Cuál es el estado de oxidación del oxígeno en los óxidos?
-El oxígeno siempre tiene un estado de oxidación de -2 en los óxidos.
¿Cómo se determina la fórmula de un óxido básico?
-Para formular un óxido básico, se intercambian los estados de oxidación del metal y el oxígeno. El metal se coloca primero, seguido del oxígeno, y los subíndices se intercambian según los números de oxidación de cada elemento.
¿Qué pasa si los subíndices de un óxido pueden simplificarse?
-Si los subíndices de un óxido tienen números que son divisibles entre sí, se pueden simplificar para obtener una fórmula más sencilla. Por ejemplo, en el caso de Fe2O3, se puede simplificar a FeO.
¿Qué son los óxidos ácidos y cómo se forman?
-Los óxidos ácidos, también conocidos como anhídridos, se forman cuando un no metal se combina con oxígeno. Estos compuestos suelen presentar enlaces covalentes entre el no metal y el oxígeno.
¿Cómo se formula un óxido ácido como el óxido de cloro?
-Para formular un óxido ácido, se coloca primero el no metal (en este caso, cloro), luego el oxígeno. Los subíndices se determinan intercambiando los estados de oxidación de cada elemento.
¿Por qué es importante conocer los estados de oxidación al formular óxidos?
-Los estados de oxidación son cruciales para determinar la correcta proporción de los elementos en el óxido. Esto asegura que la fórmula química sea correcta y que la nomenclatura sea adecuada para identificar el compuesto.
¿Qué sucede si no se pueden simplificar los subíndices de un óxido?
-Si los subíndices no pueden simplificarse, se mantendrán tal cual en la fórmula. Por ejemplo, en el óxido de cloro (Cl2O), no se pueden simplificar los subíndices 2 y 1.
Outlines

此内容仅限付费用户访问。 请升级后访问。
立即升级Mindmap

此内容仅限付费用户访问。 请升级后访问。
立即升级Keywords

此内容仅限付费用户访问。 请升级后访问。
立即升级Highlights

此内容仅限付费用户访问。 请升级后访问。
立即升级Transcripts

此内容仅限付费用户访问。 请升级后访问。
立即升级浏览更多相关视频

RESUMEN DE NOMENCLATURA | COMPUESTOS INORGÁNICOS MAS IMPORTANTES | MÉTODO DEL COLEGIO
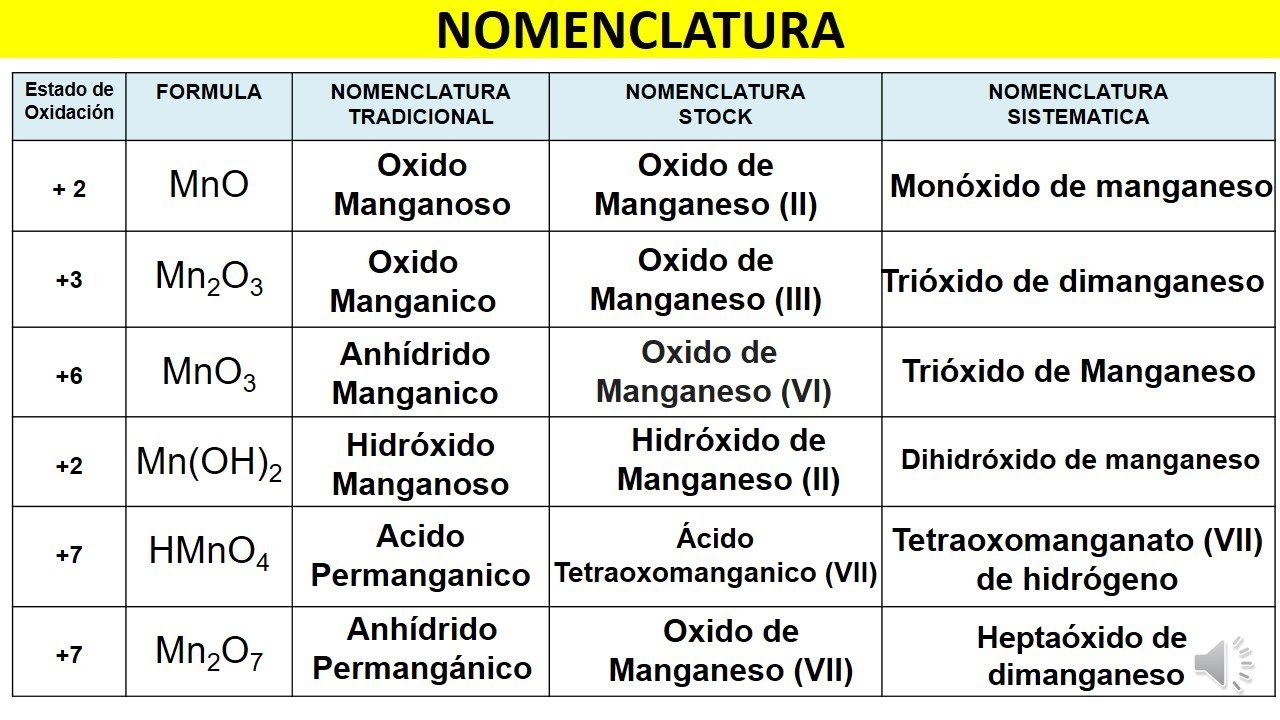
Manganeso: Compuestos (Ecuaciones Formulas y Nomenclaturas)

QUIMICA NOVENO SEMANA 2 FINAL

¿Cómo se forman los óxidos?

Hidróxidos y Oxoácidos

Reacciones con el oxígeno | Reacción con los metales y no metales | Clase en vivo
5.0 / 5 (0 votes)
