Radios del modelo de Bohr
Summary
TLDREn este video, se explora el modelo de Bohr del átomo de hidrógeno, donde se describe cómo el electrón orbita alrededor del núcleo de un protón. Aunque el modelo de Bohr no refleja la realidad exacta del átomo, sirve como una herramienta útil para análisis. Se calculan radios y velocidades de las órbitas, mostrando que las órbitas están cuantizadas, con valores permitidos para diferentes niveles de energía. Se detallan cálculos matemáticos, como el radio más pequeño (R1) y cómo este cambia cuando el valor de n varía, reflejando la estructura cuantizada del átomo.
Takeaways
- 😀 El modelo de Bohr describe un átomo de hidrógeno con un protón en el núcleo y un electrón orbitando en niveles discretos.
- 😀 El modelo de Bohr no refleja completamente la realidad, pero es útil para analizar ciertos aspectos del átomo.
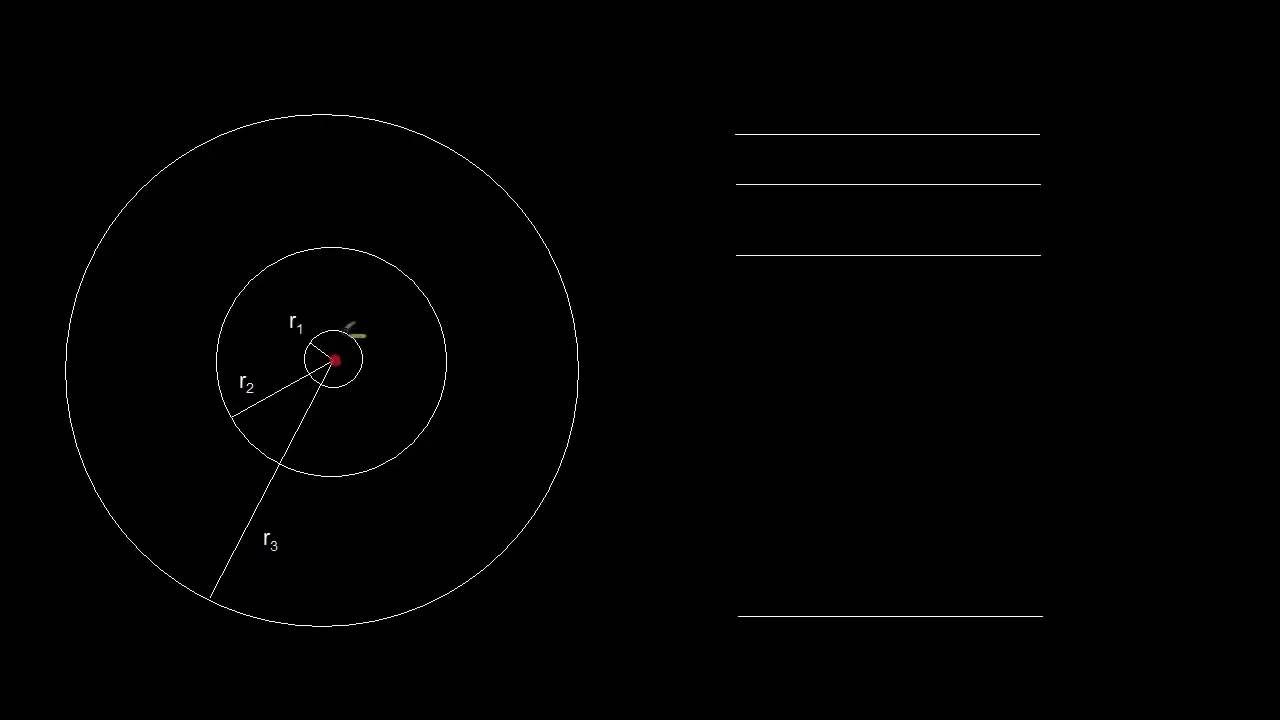
- 😀 La órbita más pequeña en el modelo de Bohr tiene un radio de 5.3 × 10^-11 m, conocido como R1.
- 😀 Los radios de las órbitas en el modelo de Bohr están cuantizados y dependen del valor del entero n, que representa el nivel de energía del electrón.
- 😀 El radio de la órbita más pequeña (R1) es igual al primer valor de n, y los radios de órbitas mayores se calculan multiplicando R1 por n^2.
- 😀 La velocidad del electrón se puede calcular usando la constante de Planck, la masa del electrón, y el radio de la órbita.
- 😀 Para n = 1, la velocidad del electrón es aproximadamente 2.2 × 10^6 m/s.
- 😀 La ecuación para la velocidad del electrón en el modelo de Bohr se deriva del momento angular cuantizado y la teoría clásica.
- 😀 La cuantización de los radios significa que no hay órbitas intermedias entre los radios permitidos en el modelo de Bohr.
- 😀 Los niveles de energía del átomo de hidrógeno están asociados con cada radio permitido, siendo cada radio correspondiente a un nivel de energía específico.
Q & A
¿Qué es el modelo de Bohr del átomo de hidrógeno?
-El modelo de Bohr describe el átomo de hidrógeno con un protón en el núcleo y un electrón orbitando alrededor de él. Aunque no refleja la realidad exacta, es un modelo útil para entender la estructura del átomo en términos de órbitas cuantizadas y niveles de energía.
¿Qué se entiende por el radio de la órbita en el modelo de Bohr?
-El radio de la órbita en el modelo de Bohr se refiere a la distancia entre el electrón y el núcleo. En el caso del átomo de hidrógeno, el primer radio (R1) es 5.3 * 10^-11 m, y se puede calcular para órbitas de mayor tamaño multiplicando R1 por un entero n.
¿Cuál es el valor de R1 y por qué es importante?
-El valor de R1 es 5.3 * 10^-11 m y es importante porque representa el radio de la órbita más pequeña según el modelo de Bohr. Este valor es clave para calcular los radios de órbitas más grandes y los niveles de energía asociados.
¿Cómo se calcula la velocidad del electrón en el modelo de Bohr?
-La velocidad del electrón en el modelo de Bohr se calcula utilizando la fórmula v = n * h / (2 * pi * m * r), donde n es el número cuántico, h es la constante de Planck, m es la masa del electrón, y r es el radio de la órbita.
¿Qué unidades se deben obtener al calcular la velocidad del electrón?
-Al calcular la velocidad del electrón, las unidades que deben obtenerse son metros por segundo (m/s). En el caso del modelo de Bohr, la velocidad calculada para n=1 es aproximadamente 2.2 * 10^6 m/s.
¿Cómo se obtienen los radios para n > 1 en el modelo de Bohr?
-Para obtener los radios para n > 1, se utiliza la fórmula r = n^2 * R1, donde R1 es el radio para n=1. Por ejemplo, para n=2, el radio es 4 veces R1, y para n=3, el radio es 9 veces R1.
¿Qué relación existe entre el número cuántico n y los radios en el modelo de Bohr?
-El número cuántico n está directamente relacionado con el radio de la órbita. A medida que n aumenta, el radio también aumenta, y se calcula como n^2 * R1, donde R1 es el radio para n=1.
¿Qué significa que los radios en el modelo de Bohr estén cuantizados?
-Que los radios estén cuantizados significa que solo ciertos radios específicos están permitidos para el electrón. No puede haber radios intermedios entre estos valores, lo que implica que las órbitas del electrón están limitadas a ciertos tamaños.
¿Cómo se relacionan los radios permitidos con los niveles de energía en el modelo de Bohr?
-Cada radio permitido en el modelo de Bohr corresponde a un nivel de energía distinto. Los niveles de energía están cuantizados, y cada órbita tiene una energía específica asociada, que depende de la distancia del electrón al núcleo.
¿Cuál es la importancia de calcular los radios y las velocidades en el modelo de Bohr?
-Calcular los radios y las velocidades en el modelo de Bohr es importante porque nos permite entender cómo se distribuyen los electrones en el átomo y cómo están relacionados con los niveles de energía. Estos cálculos son fundamentales para explicar fenómenos como la emisión de luz en los átomos.
Outlines

Этот раздел доступен только подписчикам платных тарифов. Пожалуйста, перейдите на платный тариф для доступа.
Перейти на платный тарифMindmap

Этот раздел доступен только подписчикам платных тарифов. Пожалуйста, перейдите на платный тариф для доступа.
Перейти на платный тарифKeywords

Этот раздел доступен только подписчикам платных тарифов. Пожалуйста, перейдите на платный тариф для доступа.
Перейти на платный тарифHighlights

Этот раздел доступен только подписчикам платных тарифов. Пожалуйста, перейдите на платный тариф для доступа.
Перейти на платный тарифTranscripts

Этот раздел доступен только подписчикам платных тарифов. Пожалуйста, перейдите на платный тариф для доступа.
Перейти на платный тариф5.0 / 5 (0 votes)