Absorción y emisión
Summary
TLDREn este video, se explica el modelo de Bohr del átomo de hidrógeno, enfocándose en el comportamiento del electrón en diferentes niveles de energía. Se describe cómo un electrón puede absorber energía y saltar a un nivel superior, y cómo, al volver a un estado de menor energía, emite un fotón. A través de las ecuaciones relacionadas con la energía y la longitud de onda, se introduce la constante de Rydberg, que ayuda a explicar el espectro de emisión del hidrógeno. El video conecta la teoría de Bohr con la observación experimental de la luz emitida por el átomo de hidrógeno.
Takeaways
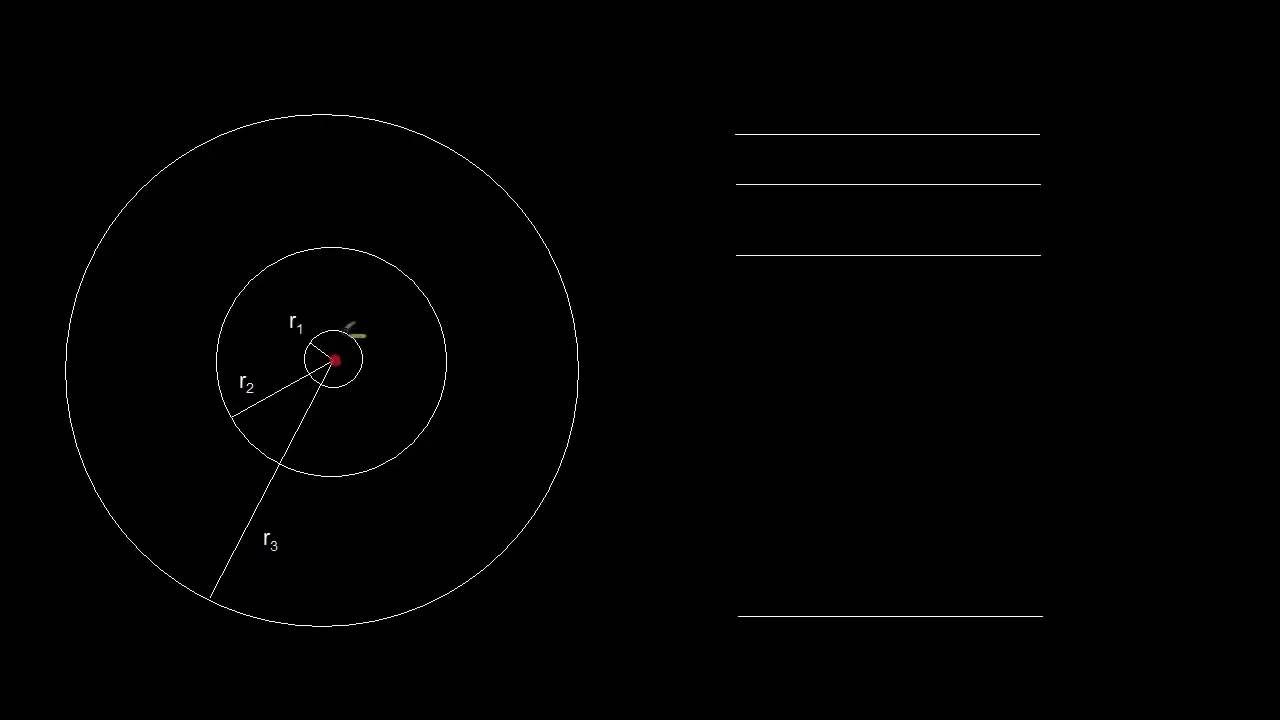
- 😀 El modelo de Bohr describe cómo los electrones en un átomo de hidrógeno ocupan niveles de energía específicos.
- 😀 El átomo de hidrógeno tiene un núcleo con carga positiva y un electrón con carga negativa orbitando alrededor de él.
- 😀 El electrón en su estado fundamental ocupa el nivel de energía más bajo, representado como E1.
- 😀 Cuando el electrón absorbe energía, puede saltar a un nivel de mayor energía, alcanzando un estado excitado temporalmente.
- 😀 La energía absorbida por el electrón permite que salte de un nivel de energía menor a uno mayor, como de E1 a E3.
- 😀 El electrón eventualmente regresa al estado fundamental, emitiendo un fotón en el proceso.
- 😀 La luz emitida al regresar el electrón al estado fundamental tiene una longitud de onda relacionada con la diferencia de energía entre los niveles.
- 😀 La energía del fotón emitido es igual a la diferencia de energía entre el nivel de energía mayor (Ej) y el nivel de energía menor (Ei).
- 😀 La fórmula para la energía del fotón es E_fotón = h * nu, donde h es la constante de Planck y nu es la frecuencia.
- 😀 La relación entre la frecuencia y la longitud de onda se expresa como c = λ * nu, donde c es la velocidad de la luz, λ es la longitud de onda y nu es la frecuencia.
- 😀 La ecuación de Balmer-Rydberg describe cómo calcular la longitud de onda de la luz emitida durante la transición de electrones entre niveles de energía, utilizando la constante de Rydberg (R).
Q & A
¿Qué es el modelo de Bohr del átomo de hidrógeno?
-El modelo de Bohr describe el átomo de hidrógeno con un núcleo cargado positivamente y un electrón que orbita alrededor del núcleo a distancias específicas. Los electrones ocupan niveles discretos de energía y pueden saltar entre ellos al absorber o emitir energía en forma de fotones.
¿Cómo se comporta el electrón en el modelo de Bohr?
-En el modelo de Bohr, el electrón orbita el núcleo a una distancia específica, y cada órbita corresponde a un nivel de energía determinado. Cuando el electrón absorbe energía, puede saltar a un nivel de energía superior, y al perder energía, emite un fotón y regresa a un nivel de energía más bajo.
¿Qué ocurre cuando un electrón absorbe energía?
-Cuando un electrón absorbe la cantidad adecuada de energía, salta a un nivel de energía superior, es decir, a una órbita más alejada del núcleo. Este proceso se llama absorción de energía.
¿Qué es la emisión de luz en el contexto del modelo de Bohr?
-La emisión de luz ocurre cuando un electrón, después de haber absorbido energía y saltado a un nivel superior, regresa a un nivel de energía más bajo. En este proceso, el electrón emite un fotón, que es una partícula de luz, con una longitud de onda característica.
¿Cómo se calcula la energía del fotón emitido?
-La energía del fotón emitido se calcula como la diferencia de energía entre los dos niveles involucrados, es decir, la diferencia entre el nivel de energía final (Ej) y el nivel de energía inicial (Ei). Esta energía se puede relacionar con la frecuencia del fotón usando la constante de Planck (h) y la velocidad de la luz (c).
¿Qué es la constante de Rydberg y cómo se utiliza?
-La constante de Rydberg (r) es una constante que aparece en la ecuación que relaciona la longitud de onda del fotón emitido con las diferencias de energía entre niveles. Su valor es 1.097 x 10^7 1/m. Esta constante es crucial para describir el espectro de emisión del hidrógeno.
¿Qué ecuación describe la relación entre la longitud de onda y las diferencias de niveles de energía?
-La ecuación fundamental es: 1/λ = r (1/n_i² - 1/n_j²), donde λ es la longitud de onda del fotón emitido, n_i y n_j son los números de los niveles de energía involucrados, y r es la constante de Rydberg.
¿Cómo se llega a la ecuación de Rydberg desde las fórmulas anteriores?
-Para obtener la ecuación de Rydberg, se comienza con la relación entre la energía del fotón y las diferencias de energía entre niveles. Al sustituir las expresiones para los niveles de energía en términos de n (el número cuántico), y luego simplificar, se obtiene la fórmula de Rydberg que relaciona la longitud de onda con los niveles de energía.
¿Por qué la ecuación de Rydberg es importante?
-La ecuación de Rydberg es fundamental porque permite predecir y explicar todo el espectro de emisión del hidrógeno. A través de esta ecuación, podemos calcular la longitud de onda de la luz emitida cuando un electrón cae a un nivel de energía inferior, lo que explica los colores observados en el espectro de emisión del hidrógeno.
¿Qué representa cada término en la ecuación de Rydberg?
-En la ecuación de Rydberg, 1/λ es la inversa de la longitud de onda del fotón emitido, r es la constante de Rydberg, y n_i y n_j son los números cuánticos correspondientes a los niveles de energía inicial y final del electrón. La diferencia entre estos niveles determina la longitud de onda de la luz emitida.
Outlines

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowMindmap

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowKeywords

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowHighlights

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowTranscripts

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowBrowse More Related Video
5.0 / 5 (0 votes)