EDUCA PE| ENSINO MÉDIO | QUÍMICA | 1º ANO I QUANTIDADES EM QUÍMICA I PARTE 2
Summary
TLDREn esta clase de química, el profesor Emanuel Marisco explica conceptos clave sobre los cálculos químicos. Abarca el cálculo de la masa molecular de diferentes compuestos, incluyendo agua, etanol y sulfato de aluminio. Además, enseña cómo calcular la molécula-grama y su relación con el número de moléculas, con ejemplos prácticos que incluyen la glicosa y el etanol. La clase también introduce el concepto de volumen molar y su aplicación en condiciones normales de temperatura y presión (CNTP y CPTP), explicando cómo calcular el volumen de gases como el propano y el sulfuro de hidrógeno. Un enfoque práctico y accesible para estudiantes de química.
Takeaways
- 😀 La masa molecular de una molécula se calcula sumando el producto del número de átomos de cada elemento por su respectiva masa atómica.
- 😀 La masa molecular de un compuesto es una medida que indica cuántas veces es más pesada que un doceavo de la masa del carbono-12.
- 😀 Para calcular la masa molecular de un compuesto, multiplicamos el número de átomos de cada elemento por su masa atómica y luego sumamos los resultados.
- 😀 La molécula-grama (mol) es similar a la masa molecular, pero se expresa en gramos y corresponde a un mol de partículas (6.02 × 10^23).
- 😀 El cálculo de la masa molecular es sencillo, pero requiere atención al multiplicar correctamente el número de átomos por la masa atómica de cada elemento.
- 😀 En el caso de la glicosa, con 3.6 g, el número de moléculas se calcula utilizando la regla de tres y el número de Avogadro.
- 😀 La regla de tres se utiliza comúnmente para convertir entre gramos y número de moléculas, considerando la masa molar de la sustancia.
- 😀 El volumen molar de los gases puede calcularse usando condiciones normales de temperatura y presión (CNTP, 22.4 L) o condiciones estándar (CPTP, 22.7 L).
- 😀 El volumen de un gas en condiciones normales se puede calcular con la regla de tres, teniendo en cuenta la masa molar del gas y su volumen molar.
- 😀 En el caso del propano, se calculó el volumen que ocupan 8.8 g del gas en condiciones normales utilizando la regla de tres, obteniendo 4.48 litros.
Q & A
¿Qué es la masa molecular de una molécula?
-La masa molecular se calcula sumando el producto del índice de átomos por la masa atómica respectiva de cada elemento en la molécula. Indica cuántas veces la masa de una molécula es más pesada que un doceavo de la masa del carbono-12.
¿Cómo se calcula la masa molecular del agua (H2O)?
-Para calcular la masa molecular del agua, multiplicamos el índice de átomos de hidrógeno (2) por su masa atómica (1) y el índice de oxígeno (1) por su masa atómica (16), luego sumamos los resultados: (2 * 1) + (1 * 16) = 18 unidades.
¿Qué es el mol o molécula grama?
-El mol o molécula grama es numéricamente igual a la masa molecular, pero expresada en gramos. Un mol de partículas corresponde a 6,02 x 10^23 partículas (el número de Avogadro).
¿Cómo se calcula el número de moléculas en 3,6 g de glucosa?
-Primero se calcula la masa molecular de la glucosa (C6H12O6), que es 180 g/mol. Luego, se utiliza una regla de tres simple para obtener el número de moléculas, resultando en aproximadamente 1,204 x 10^22 moléculas.
¿Cómo se determina la masa de un gas como el etanol (C2H6O) en función de su número de moléculas?
-Se calcula la masa molar del etanol (46 g/mol) y luego se usa una regla de tres para determinar la masa de un número dado de moléculas, utilizando el número de Avogadro. El resultado es 230 g para 3,0 x 10^24 moléculas.
¿Qué volumen ocupa un mol de gas en condiciones normales de temperatura y presión (CNTP)?
-En CNTP, un mol de gas ocupa 22,4 litros. Esta es una constante que se aplica a cualquier gas en condiciones estándar.
¿Cómo se calcula el volumen ocupado por 8,8 g de propano (C3H8) en CNTP?
-Se calcula la masa molar del propano (44 g/mol), luego se usa la regla de tres para determinar el volumen de 8,8 g de propano, lo que da como resultado 4,48 litros.
¿Cómo se calcula la masa de un gas como el sulfuro de hidrógeno (H2S) en condiciones estándar de temperatura y presión (CPTP)?
-Se calcula la masa molar del H2S (34 g/mol) y luego se usa una regla de tres para determinar la masa correspondiente a un volumen de gas dado en CPTP, resultando en 6,8 g para 4,54 litros de H2S.
¿Qué es el número de Avogadro y cómo se aplica a los cálculos moleculares?
-El número de Avogadro es 6,02 x 10^23 y representa la cantidad de partículas (átomos, moléculas, etc.) en un mol de una sustancia. Se utiliza para convertir entre la cantidad de materia y el número de partículas en cálculos químicos.
¿Cómo se determina la masa total de una mezcla gaseosa de metano y etano en CNTP?
-Se calcula la masa molar de cada gas por separado y luego se usa la regla de tres para determinar la masa de cada uno, sumando los resultados para obtener la masa total de la mezcla.
Outlines

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraMindmap

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraKeywords

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraHighlights

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraTranscripts

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraVer Más Videos Relacionados
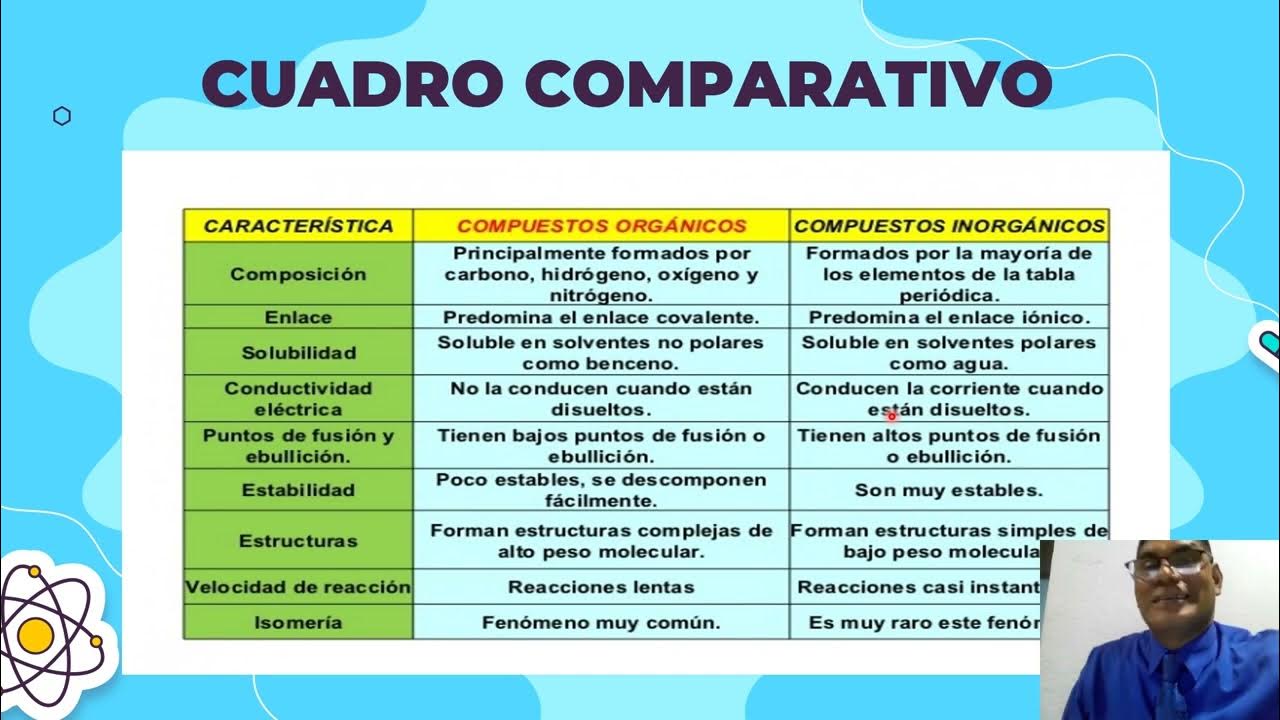
Clase quimica organica 1

[ QUIMICA FREE ] - SOLUCIONES II - Molaridad - Normalidad - Mezcla de soluciones

El Péndulo Simple

QUIMICA NOVENO SEMANA 3 FINAL

Clase 40 Fisiología Respiratoria - Coeficiente Ventilación Perfusión (V/Q) (IG:@doctor.paiva)

Aprende las valencias (o números de oxidación) de forma fácil y rápida

Primero de secundaria Ciclo BioGeoQuimico
5.0 / 5 (0 votes)