Ácidos/ Bases Fuertes y Débiles, Ka (Constante de disociación ácida) (1a parte)
Takeaways
- 😀 強酸は水溶液中で完全に解離し、例として塩酸が挙げられます。
- 😀 弱酸は部分的に解離し、その解離反応は可逆的です。例として酢酸が挙げられます。
- 😀 強塩基は水溶液中で完全に解離し、例として水酸化ナトリウムが挙げられます。
- 😀 弱塩基は部分的に解離し、その解離反応も可逆的です。例としてアンモニアが挙げられます。
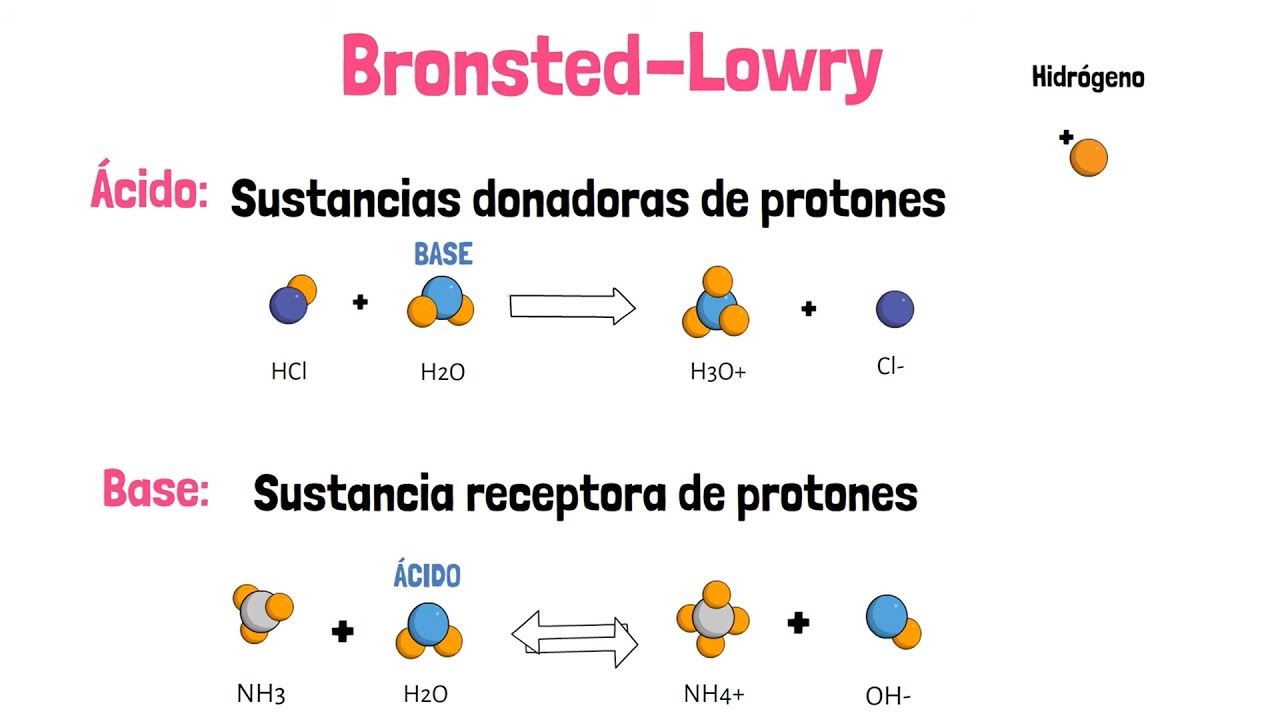
- 😀 酸と塩基はそれぞれ共役酸や共役塩基を形成します。
- 😀 弱酸の解離は、酸の濃度とその共役塩基の濃度に基づく定数Kaを用いて表されます。
- 😀 弱塩基の場合、解離定数はKbとして表されます。
- 😀 Kaの値が大きいほど、酸の強さが強く、より多くの水素イオン(H⁺)が生成されます。
- 😀 酢酸よりも蟻酸のKa値が大きいため、蟻酸は酢酸よりも強い酸であると言えます。
- 😀 酸と塩基のKaまたはKb値が高いほど、それらはより多く解離し、強い酸または塩基になります。
Q & A
強酸とは何ですか?
-強酸は、水に溶解すると完全かつ不可逆的に解離する酸です。例としては、塩酸(HCl)があり、水に溶けると水素イオン(H⁺)と塩化物イオン(Cl⁻)に解離します。
弱酸の特徴は何ですか?
-弱酸は、水に溶けると部分的に解離し、その反応は可逆的です。例えば、酢酸(CH₃COOH)が挙げられ、酢酸は水に溶けると水素イオン(H⁺)とアセテートイオン(CH₃COO⁻)に部分的に解離します。
強塩基とは何ですか?
-強塩基は、水に溶解すると完全かつ不可逆的に解離する塩基です。例としては、水酸化ナトリウム(NaOH)があり、水に溶けるとナトリウムイオン(Na⁺)と水酸化物イオン(OH⁻)に解離します。
弱塩基の特徴は何ですか?
-弱塩基は、水に溶けると部分的に解離し、その反応は可逆的です。例えば、アンモニア(NH₃)が挙げられ、アンモニアは水に溶けるとアンモニウムイオン(NH₄⁺)と水酸化物イオン(OH⁻)に部分的に解離します。
酸と塩基の共役対とは何ですか?
-酸と塩基の共役対は、酸が解離してできる塩基や、塩基が解離してできる酸のペアです。例えば、酢酸(酸)とアセテートイオン(塩基)、アンモニア(塩基)とアンモニウムイオン(酸)が共役対を形成します。
酸解離定数(Ka)はどのように計算されますか?
-酸解離定数(Ka)は、酸の解離平衡の定数であり、次の式で計算されます: Ka = [H⁺] × [共役塩基] / [酸] この値は酸がどれだけ解離するかを示します。
酢酸の酸解離定数(Ka)の値はどのくらいですか?
-酢酸の酸解離定数(Ka)は、1.8 × 10⁻⁵です。これは、酢酸が水に溶けるときに部分的に解離する度合いを示します。
塩基解離定数(Kb)はどのように計算されますか?
-塩基解離定数(Kb)は、塩基の解離平衡の定数であり、次の式で計算されます: Kb = [共役酸] × [OH⁻] / [塩基] この値は塩基がどれだけ解離するかを示します。
アンモニアの塩基解離定数(Kb)の値はどのくらいですか?
-アンモニアの塩基解離定数(Kb)は、1.8 × 10⁻⁵です。これは、アンモニアが水に溶けるときに部分的に解離する度合いを示します。
Kaの値が大きいほど酸の強さはどうなりますか?
-Kaの値が大きいほど、酸はより完全に解離し、酸の強さが強くなります。例えば、蟻酸は酢酸よりも大きなKa値を持ち、より強い酸であることを示しています。
Outlines

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレードMindmap

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレードKeywords

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレードHighlights

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレードTranscripts

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレード5.0 / 5 (0 votes)