pH y pOH: Cálculos con ácidos y base débiles
Summary
TLDREste video explica detalladamente cómo calcular el pH de soluciones de ácidos y bases débiles, comparándolos con los de ácidos y bases fuertes. A través de ejemplos prácticos, se describe cómo escribir la ecuación de disociación, calcular la constante de acidez, y utilizar la fórmula cuadrática para resolver los valores de concentración en equilibrio. Además, se explica la aproximación simplificada para facilitar los cálculos, terminando con un ejemplo para ácidos y otro para bases débiles. El video también incluye ejercicios prácticos para que los espectadores puedan aplicar lo aprendido.
Takeaways
- 😀 Es importante haber visto el vídeo sobre cómo calcular el pH para ácidos y bases fuertes antes de abordar el cálculo para ácidos y bases débiles.
- 😀 Los valores de pKa se utilizan para calcular la constante de acidez (Ka) para un ácido débil, convirtiendo el pKa a Ka mediante la fórmula Ka = 10^(-pKa).
- 😀 En los ejercicios de pH para ácidos débiles, es esencial escribir la reacción de disociación del ácido y establecer los valores iniciales para las concentraciones.
- 😀 El equilibrio químico se representa en tres momentos: inicio, cambio y equilibrio, lo que permite calcular las concentraciones de los productos y reactivos en equilibrio.
- 😀 Para resolver ecuaciones cuadráticas derivadas de la constante de acidez, se pueden usar dos métodos: el desarrollo completo de la ecuación o una aproximación si el valor de x es pequeño.
- 😀 En el caso de ácidos débiles, se puede hacer una aproximación de que la concentración inicial no se ve significativamente alterada por la disociación (x es muy pequeño).
- 😀 La ecuación cuadrática para resolver la constante de acidez lleva a un valor de x que permite calcular la concentración de protones (H+) y, a partir de ahí, el pH.
- 😀 Al calcular el pH de una solución de ácido acético, el pH se determina como el logaritmo negativo de la concentración de protones (H+) en equilibrio.
- 😀 El cálculo del pH de una base débil involucra una reacción de disociación que incluye la interacción con el agua, formando el ion OH- y el ion H+.
- 😀 El pH de una base débil se calcula utilizando el pOH y la relación pH + pOH = 14, donde el pOH se calcula a partir de la constante de disociación de la base.
- 😀 Se recomienda practicar con ejercicios similares para afianzar el cálculo del pH de ácidos y bases débiles, aplicando las mismas técnicas y métodos de aproximación.
Q & A
¿Qué es el pH y cómo se calcula para ácidos y bases débiles?
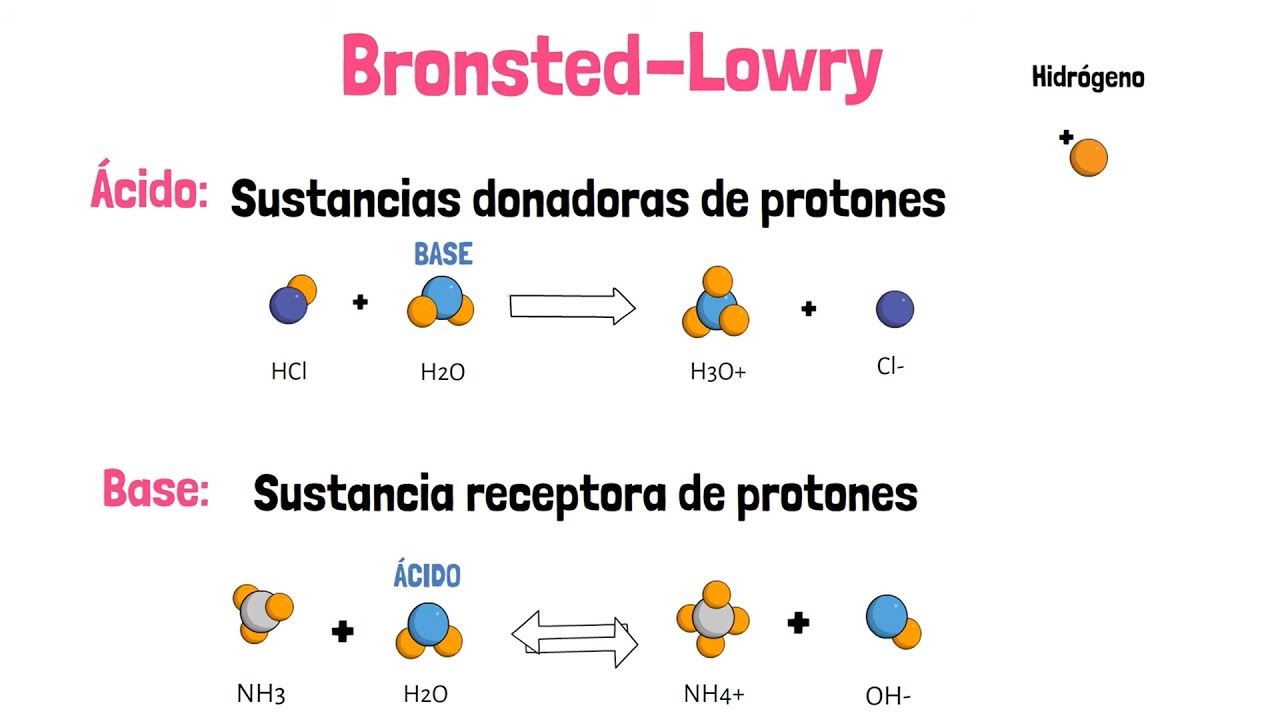
-El pH es una medida de la concentración de iones de hidrógeno (protones) en una solución. Para ácidos y bases débiles, el cálculo del pH implica usar la constante de acidez (Ka) o la constante de basicidad (Kb) en un equilibrio químico. Se deben escribir las ecuaciones de disociación, aplicar la constante de equilibrio y resolver para encontrar la concentración de protones en equilibrio, lo cual se usa para calcular el pH.
¿Por qué es importante conocer el valor de pKa en el cálculo del pH?
-El valor de pKa es importante porque nos permite calcular la constante de acidez (Ka) de un ácido débil. Al tener la constante de acidez, podemos usarla para determinar la concentración de iones de hidrógeno en equilibrio, que es esencial para calcular el pH de la solución.
¿Cómo se realiza la disociación de ácidos y bases débiles en una solución?
-La disociación de ácidos y bases débiles ocurre de manera incompleta, lo que significa que no toda la sustancia se convierte en iones. Por ejemplo, el ácido acético se disocia en iones de acetato y protones. Este proceso es reversible, y se describe mediante una constante de equilibrio, que ayuda a determinar la cantidad de disociación en equilibrio.
¿Cuál es la diferencia entre un ácido fuerte y un ácido débil en términos de disociación?
-Un ácido fuerte se disocia completamente en agua, liberando todos sus protones, mientras que un ácido débil solo se disocia parcialmente, lo que significa que solo una fracción de las moléculas de ácido se convierte en iones de hidrógeno en solución.
¿Qué significa un valor de pKa cercano a cero?
-Un valor de pKa cercano a cero indica que el ácido tiene una constante de acidez (Ka) muy alta, lo que significa que se disocia casi completamente en iones en solución. Esto es característico de los ácidos fuertes.
¿Cómo se resuelve un ejercicio de pH para ácidos débiles?
-Para resolver un ejercicio de pH para ácidos débiles, primero escribimos la ecuación de disociación y establecemos las concentraciones iniciales, los cambios y las concentraciones en equilibrio. Luego, usamos la constante de acidez para escribir la expresión de equilibrio y resolverla. Dependiendo de la constante, podemos usar la ecuación cuadrática o una aproximación si el valor de x es muy pequeño.
¿Qué método se utiliza para aproximar el valor de x en los cálculos de pH?
-Se utiliza una aproximación en la que se asume que el valor de x es muy pequeño y, por lo tanto, no altera significativamente la concentración inicial del ácido o la base. Esta simplificación hace que los cálculos sean más rápidos, aunque solo es válida cuando la constante de acidez (Ka) es pequeña.
¿Qué es la constante de acidez (Ka) y cómo se calcula?
-La constante de acidez (Ka) es una medida de la tendencia de un ácido débil a disociarse en solución. Se calcula utilizando el valor de pKa, aplicando la fórmula Ka = 10^(-pKa). Este valor es clave para determinar la concentración de protones en solución y, por lo tanto, el pH.
¿Cómo se calcula el pH de una base débil?
-Para calcular el pH de una base débil, primero calculamos el pOH, que es similar al cálculo de pH pero con la constante de basicidad (Kb). Se escribe la ecuación de disociación de la base, se resuelve para la concentración de iones OH-, y luego se usa la relación pH + pOH = 14 para encontrar el pH.
¿Por qué no se considera el agua en las ecuaciones de disociación de ácidos y bases débiles?
-El agua no se considera en las ecuaciones de disociación de ácidos y bases débiles porque su concentración es muy alta y constante (aproximadamente 55.5 M), por lo que no influye significativamente en el equilibrio químico. Solo se consideran las concentraciones de los ácidos y las bases que se disocian.
Outlines

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowMindmap

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowKeywords

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowHighlights

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowTranscripts

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowBrowse More Related Video
5.0 / 5 (0 votes)