Clases de REACCIONES Químicas [Teoría-Ejemplos-Problemas] @quimicainsitu
Summary
TLDREl script proporciona una introducción detallada a las reacciones químicas, abarcando su definición, representación a través de ecuaciones químicas y clasificación. Se exploran los reactivos y productos, así como ejemplos como la combustión de metano. Seguidamente, se clasifican las reacciones en cuatro tipos según su estructura: síntesis, descomposición, desplazamiento simple y doble. Además, se consideran criterios de energía, distinguiendo entre endotérmicas y exotérmicas, y la dirección de las reacciones, diferenciando entre irreversibles y reversibles, con equilibrios químicos como ejemplo. El video concluye con una actividad para que el espectador practique la clasificación de reacciones químicas y identifique reactivos y productos, fomentando el aprendizaje y la comprensión del tema.
Takeaways
- 🌟 Las reacciones químicas son procesos en los que una sustancia inicial (reactivos) se transforma en sustancias finales diferentes (productos).
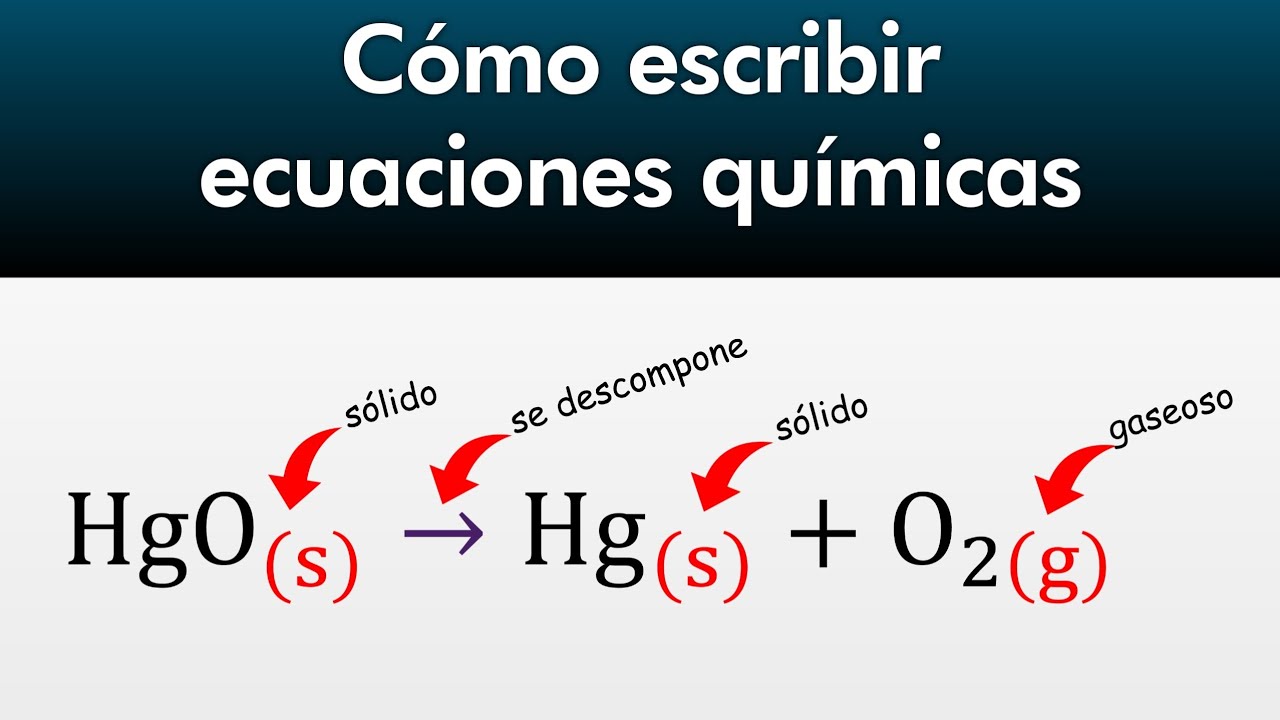
- 📜 La representación de las reacciones químicas se conoce como ecuación química, que utiliza símbolos y fórmulas químicas de los reactivos y productos.
- 🔥 El ejemplo de la combustión del metano muestra cómo los reactivos (metano y oxígeno) se transforman en productos (dióxido de carbono y agua).
- ⚖️ Los coeficientes en las ecuaciones químicas, que se explicarán en un video futuro, son importantes para entender las proporciones en las reacciones.
- 🤝 La clasificación de las reacciones químicas se basa en tres criterios principales: estructura de la reacción, energía involucrada y dirección de la reacción.
- 🔬 Las reacciones de síntesis o formación son aquellas en las que dos o más reactivos producen un único producto.
- 💥 Las reacciones de descomposición son el proceso opuesto a la síntesis, donde un único reactivo se transforma en dos o más productos.
- 🔄 Las reacciones de intercambio o sustitución simple y doble implican el desplazamiento o intercambio de átomos entre las sustancias reactivas para formar productos.
- ↔️ Las reacciones químicas también se clasifican según si son reversibles o irreversibles, lo que indica si la reacción puede ocurrir en ambas direcciones o solo en una.
- ⚡ Las reacciones endotérmicas requieren energía para ocurrir, mientras que las exotérmicas liberan energía.
- 🌿 Ejemplos de reacciones exotérmicas incluyen la respiración celular, donde la glucosa reacciona con oxígeno para producir dióxido de carbono, agua y energía.
Q & A
¿Qué son las reacciones químicas?
-Las reacciones químicas son procesos de tipo químico en los que una sustancia inicial llamada reactivos se transforman en sustancias finales diferentes conocidas como productos.
¿Cómo se representa una reacción química?
-Una reacción química se representa a través de una ecuación química que utiliza símbolos y fórmulas químicas de los reactivos y los productos involucrados en la reacción.
¿Cuál es un ejemplo de una reacción de combustión?
-Un ejemplo de una reacción de combustión es la del gas metano, donde el metano reacciona con oxígeno para transformarse principalmente en dióxido de carbono y agua.
¿Qué son los coeficientes en una ecuación química?
-Los coeficientes en una ecuación química son los números que se colocan frente a los símbolos de los reactivos y productos para indicar la cantidad de moléculas que participan en la reacción.
¿Cuáles son los cuatro tipos de reacciones según la estructura de la reacción?
-Los cuatro tipos de reacciones según la estructura son la síntesis o formación, la descomposición, el desplazamiento simple y el intercambio doble.
¿Cómo se define una reacción de síntesis?
-Una reacción de síntesis es aquella en la que a partir de dos o más reactivos se forma un único producto.
¿Qué ocurre en una reacción de descomposición?
-En una reacción de descomposición, un único reactivo se transforma en dos o más productos.
¿Cómo se clasifican las reacciones en términos de energía involucrada?
-Las reacciones se clasifican en términos de energía como endotérmicas, que absorben energía, y exotérmicas, que liberan energía.
¿Qué es una reacción endotérmica?
-Una reacción endotérmica es aquella que requiere energía para que ocurra, como la luz, el calor o la electricidad.
¿Qué es una reacción exotérmica?
-Una reacción exotérmica es aquella que libera energía durante el proceso, como la respiración celular.
¿Cómo se diferencian las reacciones irreversibles de las reversibles?
-Las reacciones irreversibles ocurren en una sola dirección, mientras que las reacciones reversibles, también conocidas como equilibrios químicos, pueden ocurrir en ambas direcciones, es decir, los productos pueden regresar a los reactivos iniciales.
¿Cuál es el propósito del ejercicio final en el script?
-El propósito del ejercicio final es permitir que los estudiantes practiquen la clasificación de las reacciones químicas y identifiquen los reactivos y los productos en cada caso.
Outlines

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantMindmap

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantKeywords

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantHighlights

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantTranscripts

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantVoir Plus de Vidéos Connexes

Reacciones Químicas

⚛Reacciones y ecuaciones químicas 🧠✴

Reacción y Balanceo de Ecuaciones Redox

Reacciones Químicas - Definición y partes de las ecuaciones químicas

REACCIONES QUÍMICAS. CLASES DE REACCIONES QUÍMICAS. REDOX (OXIDO-REDUCCIÓN), EXOTERMICAS, Y MAS.
Cómo ESCRIBIR ECUACIONES QUÍMICAS correctamente | ¡FÁCIL!
5.0 / 5 (0 votes)
