Video Enlaces Atomicos (b)
Summary
TLDREl video aborda las interacciones atómicas y los tipos de enlaces que forman los átomos. Se explican conceptos fundamentales como las fuerzas atractivas y repulsivas entre átomos, el punto de equilibrio que determina la distancia de enlace, y la energía requerida para romper estos enlaces. Se analizan los enlaces fuertes (iónicos, covalentes y metálicos) y los débiles (como los puentes de hidrógeno y las fuerzas de van der Waals), destacando sus propiedades, rigidez y energía de enlace. Esta información es esencial para entender la estructura y comportamiento de los sólidos en diversas condiciones.
Takeaways
- 😀 Los átomos experimentan fuerzas atractivas y repulsivas al acercarse, y su equilibrio se establece cuando la suma de estas fuerzas es cero.
- 😀 La distancia de equilibrio en los sólidos es aproximadamente 0,3 nanómetros, donde los átomos vibran continuamente en función de la temperatura.
- 😀 La energía en un enlace atómico es mínima en el punto de equilibrio, y se necesita energía adicional para romper este enlace.
- 😀 La rigidez de un enlace se define como la resistencia del enlace a ser deformado y se mide a través de la pendiente de la curva de fuerza versus distancia.
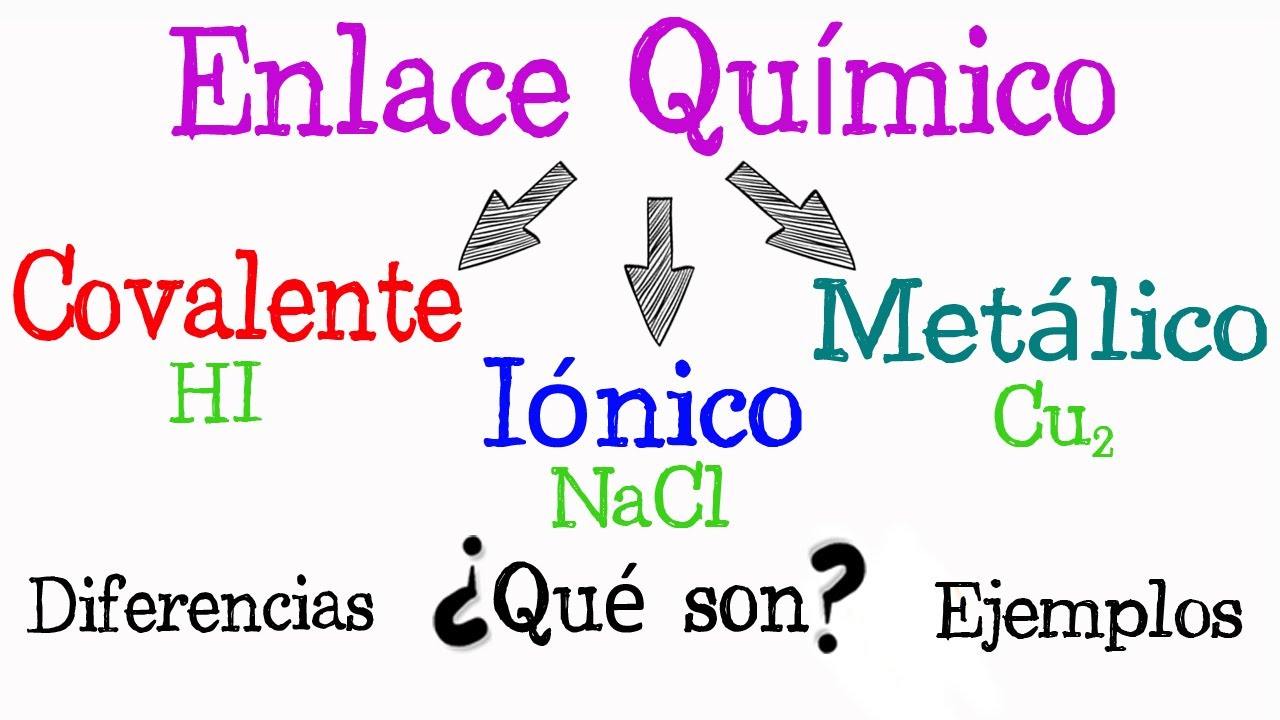
- 😀 Existen dos tipos de enlaces: fuertes (iónicos, covalentes y metálicos) y débiles (van der Waals).
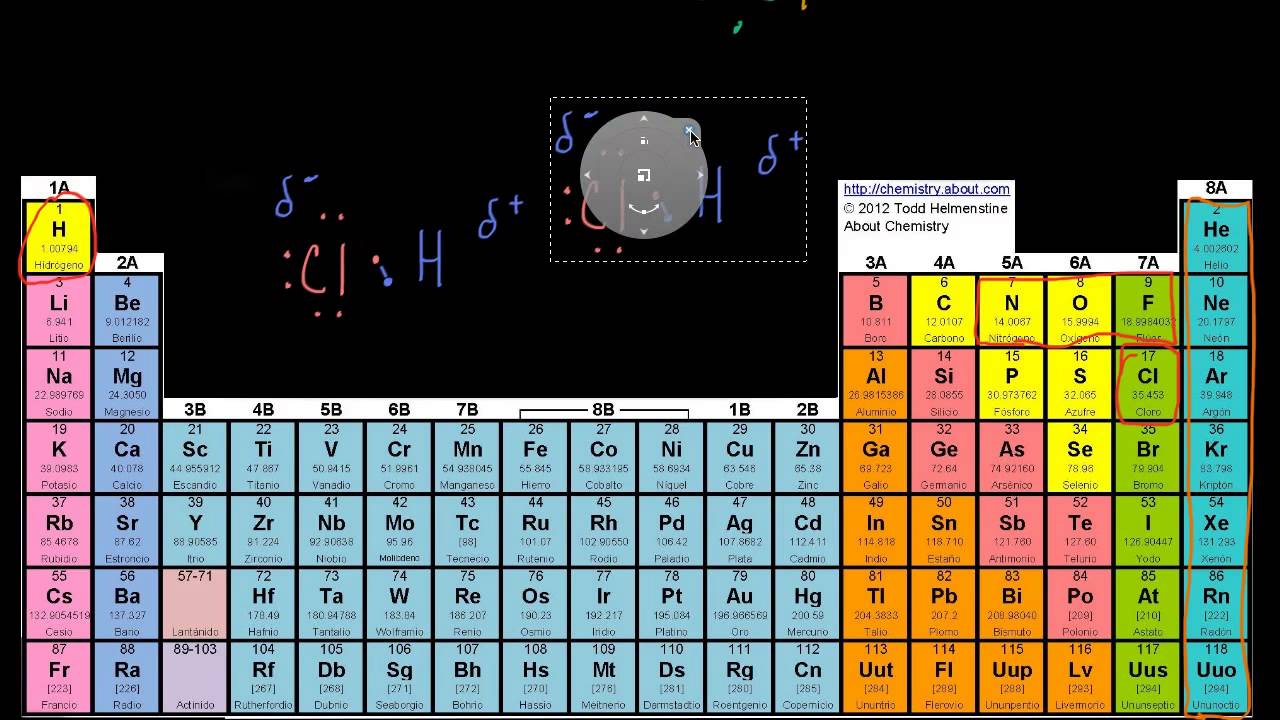
- 😀 Los enlaces iónicos se forman cuando un átomo cede un electrón a otro, resultando en la atracción entre iones cargados, como en el cloruro de sodio.
- 😀 Los enlaces covalentes implican el intercambio de electrones entre átomos no metálicos, como en la molécula de metano.
- 😀 Los enlaces metálicos son característicos de los metales, donde los electrones se deslocalizan, formando una nube que permite la conductividad eléctrica.
- 😀 Los enlaces débiles, como los puentes de hidrógeno, surgen de interacciones electrostáticas y son mucho más débiles que los enlaces fuertes.
- 😀 La resistencia de los enlaces en un sólido varía según su tipo, siendo los enlaces covalentes los más fuertes, seguidos por los metálicos, los iónicos y, por último, los enlaces débiles.
Q & A
¿Qué sucede cuando dos átomos se acercan entre sí?
-Cuando dos átomos se acercan, sienten dos tipos de fuerzas: una fuerza atractiva que los acerca y otra fuerza repulsiva que les impide acercarse demasiado.
¿Qué es el punto de equilibrio en el contexto de los átomos?
-El punto de equilibrio es la distancia a la que la suma de las fuerzas atractivas y repulsivas entre los átomos es nula, y generalmente se establece en aproximadamente 0,3 nanómetros en sólidos.
¿Cómo afecta la temperatura a la posición de equilibrio de los átomos?
-A temperaturas superiores al cero absoluto, los átomos vibran alrededor de su posición de equilibrio, lo que significa que su posición puede variar ligeramente con el aumento de temperatura.
¿Qué significa la rigidez de un enlace?
-La rigidez de un enlace es la capacidad de resistirse a ser deformado o sacado de su posición de equilibrio, y se mide a través de la pendiente de la curva de fuerza frente a distancia en el punto de equilibrio.
¿Cuáles son los tipos de enlaces químicos mencionados en el transcript?
-Los tipos de enlaces químicos son enlaces fuertes (iónicos, covalentes y metálicos) y enlaces débiles (como los enlaces de Van der Waals).
¿Cómo se forma un enlace iónico?
-Un enlace iónico se forma cuando un átomo, como el sodio, cede un electrón a otro átomo, como el cloro, resultando en la creación de iones cargados que se atraen electrostáticamente.
¿Qué caracteriza a un enlace covalente?
-En un enlace covalente, dos átomos comparten electrones para completar sus niveles de energía, como en el caso del metano, donde el carbono y el hidrógeno comparten electrones para alcanzar configuraciones estables.
¿Qué diferencia hay entre enlaces metálicos y los otros tipos de enlaces?
-En los enlaces metálicos, los electrones están deslocalizados y no se fijan a un átomo específico, formando una nube de electrones que permite propiedades como la conductividad eléctrica y la maleabilidad, a diferencia de los enlaces iónicos y covalentes.
¿Qué son los enlaces de Van der Waals y en qué se basan?
-Los enlaces de Van der Waals son interacciones débiles que surgen de dipolos atómicos o moleculares creados por distribuciones de carga no homogéneas, como en el caso del puente de hidrógeno en el agua.
¿Cómo se compara la energía de unión de los distintos tipos de enlaces?
-La energía de unión es mayor en enlaces covalentes, seguida por los metálicos, los iónicos, y por último, los enlaces débiles, que requieren menos energía para romperse.
Outlines

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraMindmap

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraKeywords

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraHighlights

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraTranscripts

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraVer Más Videos Relacionados
5.0 / 5 (0 votes)