Clase nº 3 - 1. Equilibrio quimico: el avance de reacción y la constante de equilibrio
Summary
TLDREn este vídeo se explora el equilibrio químico, definiendo el proceso y los conceptos clave como la constante de equilibrio y el avance de la reacción. Se explica cómo la energía libre de Gibbs determina si un proceso es espontáneo y cómo la constante de equilibrio relaciona las fugacidades de los componentes en un sistema químico. Además, se discute cómo los cambios en la reacción afectan la constante de equilibrio y se presentan ecuaciones clave para entender el comportamiento de los sistemas químicos en equilibrio.
Takeaways
- 🔬 Se discute el equilibrio químico y cómo se define, enfocándose en la fracción molar constante de cada componente del sistema.
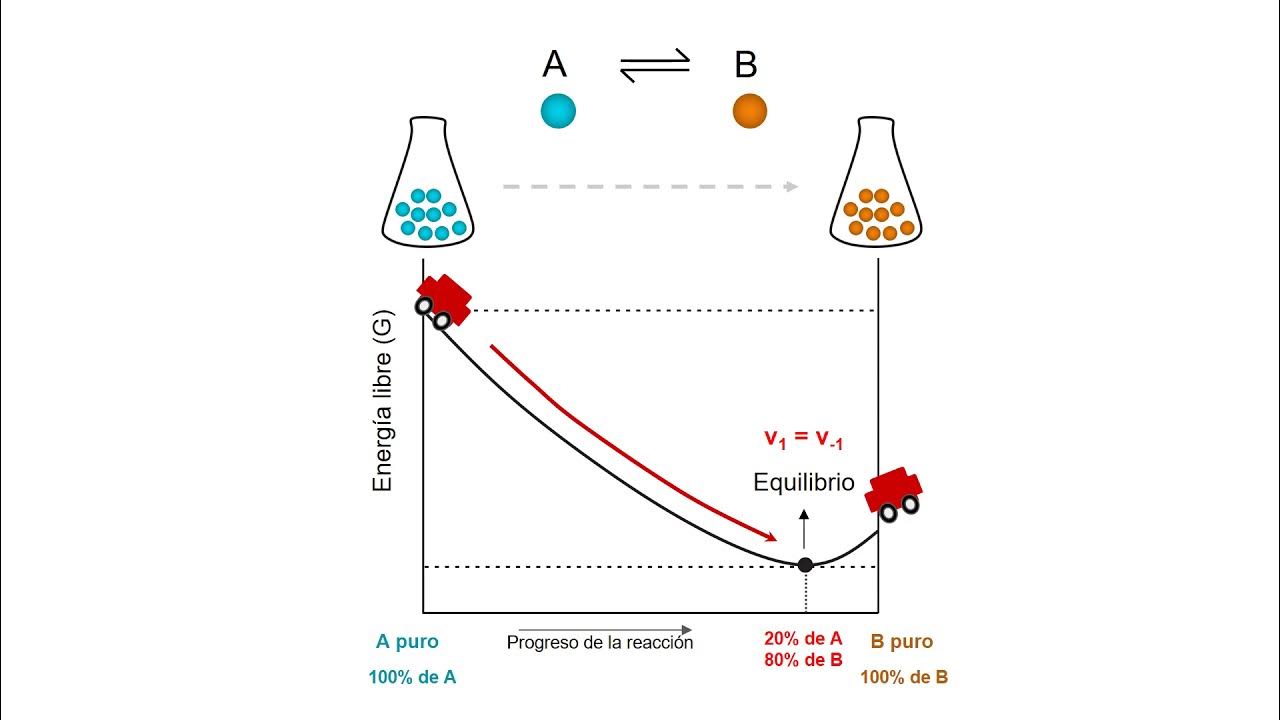
- 🧪 Se explica que el equilibrio termodinámico implica que tanto el proceso como su inverso ocurren a la misma velocidad.
- 🌡️ Se menciona la importancia de la temperatura y la presión en la determinación del equilibrio químico.
- 🔄 Se describe el concepto de reacción química y cómo se alcanza el equilibrio químico cuando las velocidades de los reactivos y productos son iguales.
- 📉 Se presenta la ecuación general de la energía libre de Gibbs (ΔG) y cómo varía con cambios en temperatura, presión y cantidad de moles de componentes.
- 📚 Se explica que la energía libre de Gibbs disminuye en un proceso espontáneo hasta alcanzar el equilibrio, donde ΔG es cero.
- 🔄 Se introduce el avance de la reacción, que mide la cantidad de reactivos transformados en productos y cómo se relaciona con los cambios en la energía libre.
- 📈 Se discute cómo la constante de equilibrio (K) se relaciona con la energía libre estándar de la reacción y cómo se calcula.
- 🌡️ Se destaca que la constante de equilibrio depende de la temperatura y puede cambiar con ella.
- 📖 Se menciona que la constante de equilibrio se puede usar para determinar las composiciones en el equilibrio y cómo se ve afectada por cambios en la reacción.
Q & A
¿Qué es el equilibrio químico y cómo se define?
-El equilibrio químico es un estado en el que la fracción molar de cada componente en un sistema se mantiene constante durante el tiempo, y tanto el proceso considerado como el proceso inverso ocurren a la misma velocidad.
¿Qué implica un proceso en equilibrio termodinámico?
-Un proceso en equilibrio termodinámico implica que el potencial químico en ambas fases es el mismo, y no hay transferencia neta de masa, aunque el sistema no esté estático.
¿Qué es una reacción química y cómo se define en términos de equilibrio?
-Una reacción química es un proceso que puede dar lugar a la formación de productos a partir de reactivos. Se define como en equilibrio cuando la velocidad de conversión de reactivos a productos es la misma que la velocidad de conversión de productos a reactivos.
¿Cómo se determina si un sistema está en equilibrio material?
-Un sistema se encuentra en equilibrio material si la fracción molar de cada componente se mantiene constante durante el tiempo.
¿Qué es el avance de la reacción y cómo se mide?
-El avance de la reacción es una variable que determina la cantidad de moles de reactivos que se han transformado en productos según la reacción química. Se mide como una constante proporcionalidad para todos los componentes, ya sean reactivos o productos.
¿Qué es el grado de avance y cómo se relaciona con el avance de la reacción?
-El grado de avance es una medida normalizada del avance de la reacción con respecto a los moles iniciales del reactivo limitante. Indica qué porcentaje del reactivo limitante ha sido transformado en productos.
¿Cómo se determina si una reacción es espontánea en términos de energía libre de Gibbs?
-Una reacción es espontánea si la energía libre de Gibbs disminuye, lo que significa que la energía del estado final debe ser menor que la del estado inicial.
¿Qué implica que la energía libre de Gibbs (ΔG) sea igual a cero para una reacción?
-Si ΔG es igual a cero, la reacción está en equilibrio, y no hay tendencia a avanzar más en cualquier dirección, ya que la energía del sistema no cambia netamente.
¿Cómo se relaciona la constante de equilibrio con la energía libre de Gibbs estándar de la reacción?
-La constante de equilibrio (K) se relaciona con la energía libre de Gibbs estándar de la reacción a través de la ecuación ΔG° = -RT ln(K), donde R es la constante de los gases y T es la temperatura.
¿Qué significa que la constante de equilibrio sea dimensionada y por qué es importante?
-Que la constante de equilibrio sea dimensionada significa que su valor es independiente de las unidades utilizadas para medir las concentraciones o presiones de los reactivos y productos. Esto es importante porque garantiza que la constante sea una medida consistente y comparable de la tendencia a alcanzar el equilibrio.
¿Cómo se determina la constante termodinámica de equilibrio para una reacción química?
-La constante termodinámica de equilibrio se determina a partir de la relación entre la energía libre de Gibbs estándar de la reacción y las fugacidades de los componentes en el estado de equilibrio.
Outlines

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraMindmap

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraKeywords

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraHighlights

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraTranscripts

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahora5.0 / 5 (0 votes)