⚠️Teorías Ácido-Base | Arrhenius, Bronsted-Lowry, Lewis⚠️ [Fácil y Rápido] | QUÍMICA |
Summary
TLDREste video ofrece una visión general de la clasificación histórica de los ácidos y las bases, comenzando con la definición de Arrhenius que describe a los ácidos como sustancias que liberan iones H+ y a las bases como aquellas que liberan iones OH- al disolverse en agua. Se mencionan ejemplos de ácidos y bases según esta teoría, incluyendo ácido clorhídrico y hidróxido de sodio. Sin embargo, el video también destaca las limitaciones de la teoría de Arrhenius y cómo Brønsted y Lowry ampliaron esta definición, considerando a los ácidos como donantes de protones y a las bases como aceptoras de protones, con ejemplos que incluyen reacciones entre ácido clorhídrico y agua, y entre amoniaco y agua. Finalmente, se introduce la teoría de Lewis, que define a los ácidos como aceptores de pares de electrones y a las bases como donantes de pares de electrones, ilustrada con la interacción entre amoniaco y trifluoruro de boro. El video concluye con una llamada a la participación de los espectadores, animándoles a dar like, comentar y compartir el contenido en redes sociales.
Takeaways
- 🍋 Desde la antigüedad, los ácidos se caracterizaban por su sabor agrio y las bases por su sabor amargo y consistencia jabonosa.
- 🧬 A finales del siglo XIX, Arrhenius propuso que los ácidos liberan iones H+ y las bases liberan iones OH- al disolverse en agua.
- 🌟 Ejemplos de ácidos de Arrhenius incluyen el ácido clorhídrico, sulfúrico, fluorhídrico, nítrico y fosfórico, que todos empiezan con la letra 'H'.
- 🔬 Los hidróxidos de sodio, potasio, magnesio y aluminio, así como el óxido de litio, son ejemplos de bases de Arrhenius, terminando en 'ida'.
- 🚫 Aunque la teoría de Arrhenius fue ampliamente aceptada, no explicaba el comportamiento de todas las sustancias químicas.
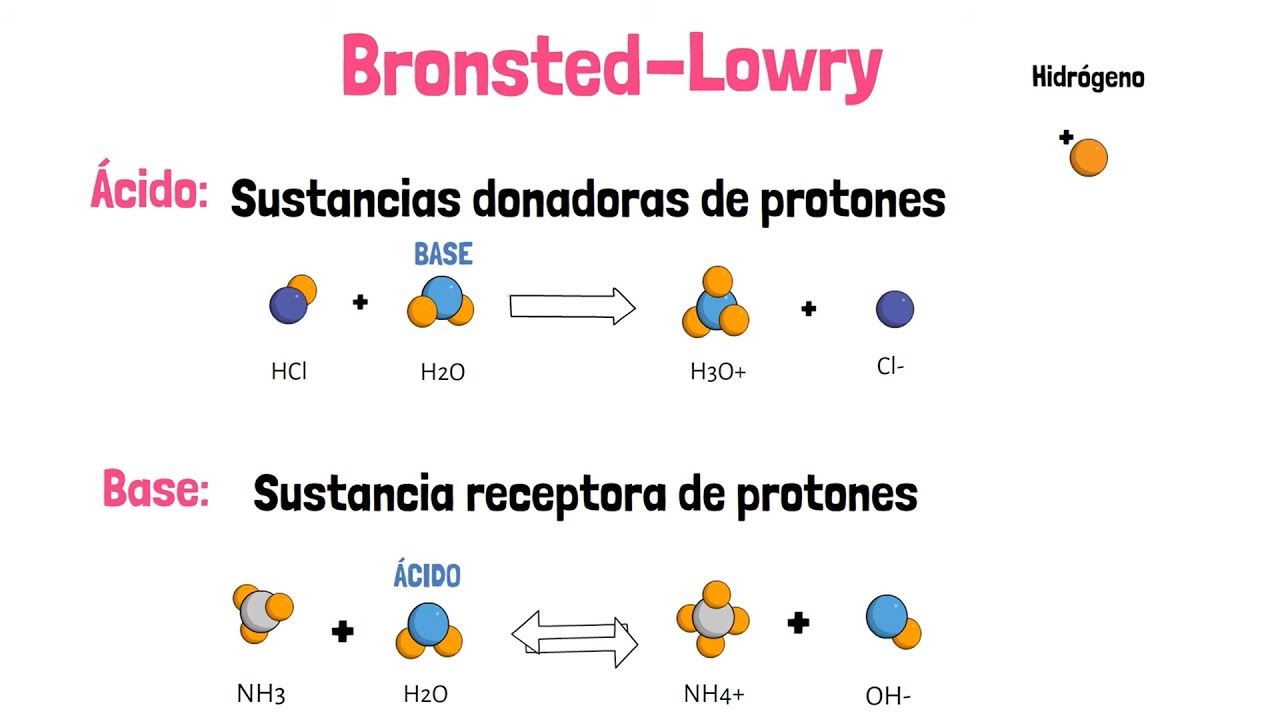
- 🔄 En 1923, Brønsted y Lowry definieron a los ácidos como sustancias capaces de donar protones y a las bases como capaces de aceptar protones.
- ⚖️ Agua actúa como una sustancia amphiprotic, es decir, puede comportarse como ácido o base dependiendo de la sustancia con la que interactúa.
- 🔄 Si una reacción química ocurre en reversa, el conjugado del ácido se convierte en la base y viceversa.
- 🔬 Lewis propuso en 1923 una teoría que mejor explica el comportamiento de los ácidos y las bases, sugiriendo que los ácidos aceptan un par de electrones y las bases los donan.
- 🌐 El amoniaco, que tiene un par de electrones no enlazados, actúa como base al donarlos, mientras que el triflouro de boro actúa como ácido al aceptarlos.
- 📚 La teoría de Lewis ofrece una explicación más amplia y detallada del concepto de ácidos y bases, ampliando el entendimiento de su comportamiento químico.
Q & A
¿Cómo se clasificaban los ácidos y las bases en la antigüedad?
-En la antigüedad, los ácidos se clasificaban como sustancias con sabor agrio y las bases como sustancias con sabor amargo y consistencia jabonosa.
¿Qué teoría propuso Arrhenius sobre los ácidos y las bases?
-Arrhenius propuso que un ácido es una sustancia capaz de liberar iones H+ cuando se disuelve en agua, y una base es una sustancia capaz de liberar iones OH-.
¿Qué es un ácido de Arrhenius y cuál es un ejemplo?
-Un ácido de Arrhenius es una sustancia que libera iones H+ en soluciones acuosas. Un ejemplo es el ácido clorhídrico, que al disolverse en agua libera un ión H+.
¿Cómo se identifican las bases de Arrhenius en sus fórmulas químicas?
-Las bases de Arrhenius generalmente terminan en 'ida' en sus fórmulas químicas, como en el caso del hidróxido de sodio (NaOH).
¿Por qué las teorías de Arrhenius no explicaban el comportamiento de algunas sustancias químicas?
-Las teorías de Arrhenius no explicaban el comportamiento de algunas sustancias porque no se cumplía la regla de liberar iones H+ o OH- en soluciones acuosas.
¿Quiénes fueron Bronsted y Lowry y qué definieron sobre los ácidos y las bases?
-Bronsted y Lowry definieron a los ácidos como sustancias capaces de donar protones (H+) y a las bases como sustancias capaces de aceptar protones.
¿Cómo se comporta el agua en la reacción química propuesta por Bronsted y Lowry?
-El agua puede recibir un protón de un ácido y donar un protón a una base, por lo que puede actuar tanto como ácido como base, lo que se le llama comportamiento de protón donante y aceptante.
¿Qué es un ácido conjugado y una base conjugada según la teoría de Bronsted y Lowry?
-Un ácido conjugado es la especie que dona un protón en una reacción ácida-base, y una base conjugada es la especie que acepta un protón.
¿Cuál fue la contribución de la teoría de Lewis a la comprensión de los ácidos y las bases?
-La teoría de Lewis amplió la comprensión de los ácidos y las bases, definiendo a un ácido como una sustancia capaz de aceptar un par de electrones y a una base como una sustancia capaz de donar un par de electrones.
¿Cómo se relaciona el amoniaco con la teoría de Lewis?
-Según la teoría de Lewis, el amoniaco actúa como una base porque puede donar un par de electrones no enlazados, formando enlaces químicos con átomos como el boro en el trifloruro de boro.
¿Por qué es importante la teoría de Lewis para la química?
-La teoría de Lewis es importante porque proporciona una explicación más general y detallada del comportamiento de los ácidos y las bases, abarcando una amplia variedad de reacciones químicas y sustancias.
Outlines

Dieser Bereich ist nur für Premium-Benutzer verfügbar. Bitte führen Sie ein Upgrade durch, um auf diesen Abschnitt zuzugreifen.
Upgrade durchführenMindmap

Dieser Bereich ist nur für Premium-Benutzer verfügbar. Bitte führen Sie ein Upgrade durch, um auf diesen Abschnitt zuzugreifen.
Upgrade durchführenKeywords

Dieser Bereich ist nur für Premium-Benutzer verfügbar. Bitte führen Sie ein Upgrade durch, um auf diesen Abschnitt zuzugreifen.
Upgrade durchführenHighlights

Dieser Bereich ist nur für Premium-Benutzer verfügbar. Bitte führen Sie ein Upgrade durch, um auf diesen Abschnitt zuzugreifen.
Upgrade durchführenTranscripts

Dieser Bereich ist nur für Premium-Benutzer verfügbar. Bitte führen Sie ein Upgrade durch, um auf diesen Abschnitt zuzugreifen.
Upgrade durchführenWeitere ähnliche Videos ansehen

Teorías ácido - base (Arrhenius, Bronsted-Lowry, Lewis)

[Química] Teorías🧠 Acido-bases Arrhenius, Brönsted-Lowry, Lewis

El video que DEBES ver para entender ÁCIDOS & BASES

SOLUCIONES ÁCIDAS Y BÁSICAS

14-Equilibrios Ácido-Base. 1.0 Definiciones de Arrhenius, Bronsted-Lowry y Lewis.
Ácidos y Bases de Arrhenius y Bronsted
5.0 / 5 (0 votes)
