Dipole und ihre Wechselwirkungen
Summary
TLDRIn diesem Video wird erklärt, was ein Dipol ist und wie Dipol-Dipol-Wechselwirkungen die Eigenschaften von Stoffen beeinflussen. Der Unterschied zwischen polaren und unpolaren Molekülen wird anhand von Beispielen wie Wasser, Kohlenstoffdioxid und Chlorwasserstoff verdeutlicht. Es wird gezeigt, wie die elektrische Ladungsverteilung in Molekülen zu besonderen Wechselwirkungen führt, die unter anderem die Löslichkeit und den Schmelzpunkt von Substanzen beeinflussen. Auch wird die Bedeutung von Wasserstoffbrücken und die Begriffe hydrophil und hydrophob behandelt, um das Verhalten von Molekülen in verschiedenen Lösungsmitteln zu erklären.
Takeaways
- 😀 Dipole sind Moleküle mit zwei entgegengesetzt geladenen Polen, die durch die Elektronegativitätsdifferenz von Atomen entstehen.
- 😀 Ein Dipol-Molekül ist nur dann vorhanden, wenn das Molekül mindestens eine polare Atombindung und getrennte Ladungsschwerpunkte hat.
- 😀 Eine polare Atombindung entsteht, wenn die Elektronegativitätsdifferenz zwischen den Atomen zwischen 0,5 und 1,7 liegt.
- 😀 Wassermoleküle (H₂O) sind Dipole, weil sie eine polare Atombindung und eine gewinkelte Struktur haben, die die Ladungsschwerpunkte trennt.
- 😀 Kohlenstoffdioxid (CO₂) ist kein Dipol, obwohl es polare Atombindungen enthält, da die Molekülgeometrie symmetrisch ist und die Ladungsschwerpunkte zusammenfallen.
- 😀 Chlorwasserstoff (HCl) ist ein Dipol, da die Ladungsschwerpunkte (negative Partialladung am Chlor und positive Partialladung am Wasserstoff) getrennt sind.
- 😀 Dipol-Dipol-Wechselwirkungen treten auf, wenn sich gegensätzliche Ladungen von verschiedenen Dipol-Molekülen anziehen oder abstoßen.
- 😀 Dipol-Dipol-Wechselwirkungen beeinflussen die physikalischen Eigenschaften von Stoffen, wie zum Beispiel den Schmelzpunkt und Siedepunkt.
- 😀 Wasserstoffbrücken sind eine besondere Art von Dipol-Dipol-Wechselwirkungen, die besonders stark im Wassermolekül sind und für dessen hohe Stabilität verantwortlich sind.
- 😀 Hydrophile Stoffe lösen sich gut in Wasser, während hydrophobe Stoffe, wie Öl, keine Dipol-Dipol-Wechselwirkungen eingehen und sich nicht mit Wasser vermischen.
Q & A
Was ist ein Dipol?
-Ein Dipol ist ein Molekül oder ein Atom, das zwei entgegengesetzt geladene Pole besitzt. Diese Pole können positive und negative Ladungsschwerpunkte sein, die sich in der Außenwirkung ausgleichen, wodurch das Molekül insgesamt neutral erscheint.
Was bedeutet es, dass ein Molekül ein Dipol ist?
-Ein Molekül ist ein Dipol, wenn es mindestens eine polare Atombindung hat und die entgegengesetzten Ladungsschwerpunkte an unterschiedlichen Stellen im Molekül räumlich getrennt sind.
Wie erkennt man, ob ein Molekül ein Dipol ist?
-Ein Molekül ist ein Dipol, wenn es mindestens eine polare Atombindung hat (mit einer Elektronegativitätsdifferenz zwischen 0,5 und 1,7) und die Ladungsschwerpunkte örtlich voneinander getrennt sind.
Warum ist Wasser (H₂O) ein Dipol?
-Wasser ist ein Dipol, weil es polare Atombindungen zwischen Wasserstoff und Sauerstoff gibt und die Ladungsschwerpunkte durch die gewinkelte Struktur des Moleküls räumlich getrennt sind, wodurch es einen positiven und einen negativen Ladungsschwerpunkt gibt.
Warum ist Kohlendioxid (CO₂) kein Dipol?
-Kohlendioxid (CO₂) ist kein Dipol, weil es zwar polare Atombindungen zwischen Kohlenstoff und Sauerstoff gibt, das Molekül aber symmetrisch aufgebaut ist. Die Ladungsschwerpunkte der Moleküle fallen dadurch zusammen und sind nicht räumlich voneinander getrennt.
Was sind Dipol-Dipol-Wechselwirkungen?
-Dipol-Dipol-Wechselwirkungen sind Anziehungskräfte zwischen den entgegengesetzten Ladungsschwerpunkten zweier polarer Moleküle. Diese Moleküle richten sich so aus, dass sich die negativen und positiven Ladungen gegenüberstehen.
Warum mischen sich Öl und Wasser nicht?
-Öl und Wasser mischen sich nicht, weil Öl aus nicht-polaren Molekülen besteht, die keine Dipol-Dipol-Wechselwirkungen mit den polaren Wassermolekülen eingehen können. Daher bildet sich eine Trennung in zwei Phasen.
Was bedeutet hydrophil und hydrophob?
-Hydrophil bedeutet wasserfreundlich und beschreibt Substanzen, die gut in Wasser löslich sind, wie z.B. diepolare Moleküle. Hydrophob bedeutet wasserabweisend und beschreibt Substanzen, die sich nicht in Wasser lösen, wie z.B. unpolare Moleküle wie Öl.
Wie beeinflussen Dipol-Dipol-Wechselwirkungen die physikalischen Eigenschaften eines Stoffes?
-Dipol-Dipol-Wechselwirkungen beeinflussen Eigenschaften wie den Schmelzpunkt und Siedepunkt eines Stoffes. Je stärker die Wechselwirkungen, desto höher sind typischerweise diese Temperaturen.
Warum kocht Wasser bei 100°C?
-Wasser kocht bei 100°C, weil die starken Wasserstoffbrücken zwischen den Wassermolekülen (eine spezielle Form der Dipol-Dipol-Wechselwirkung) eine hohe Energie erfordern, um die Moleküle voneinander zu trennen.
Outlines

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنMindmap

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنKeywords

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنHighlights

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنTranscripts

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنتصفح المزيد من مقاطع الفيديو ذات الصلة

Wechselwirkungen zwischen Molekülen/ intermolekulare Wechselwirkungen

Einfach erklärt: London-Disperions- Dipol-Dipol- H-Brücken-Wechselwirkungen 4k 60Fps

Was sind Wasserstoffbrückenbindungen? - REMAKE
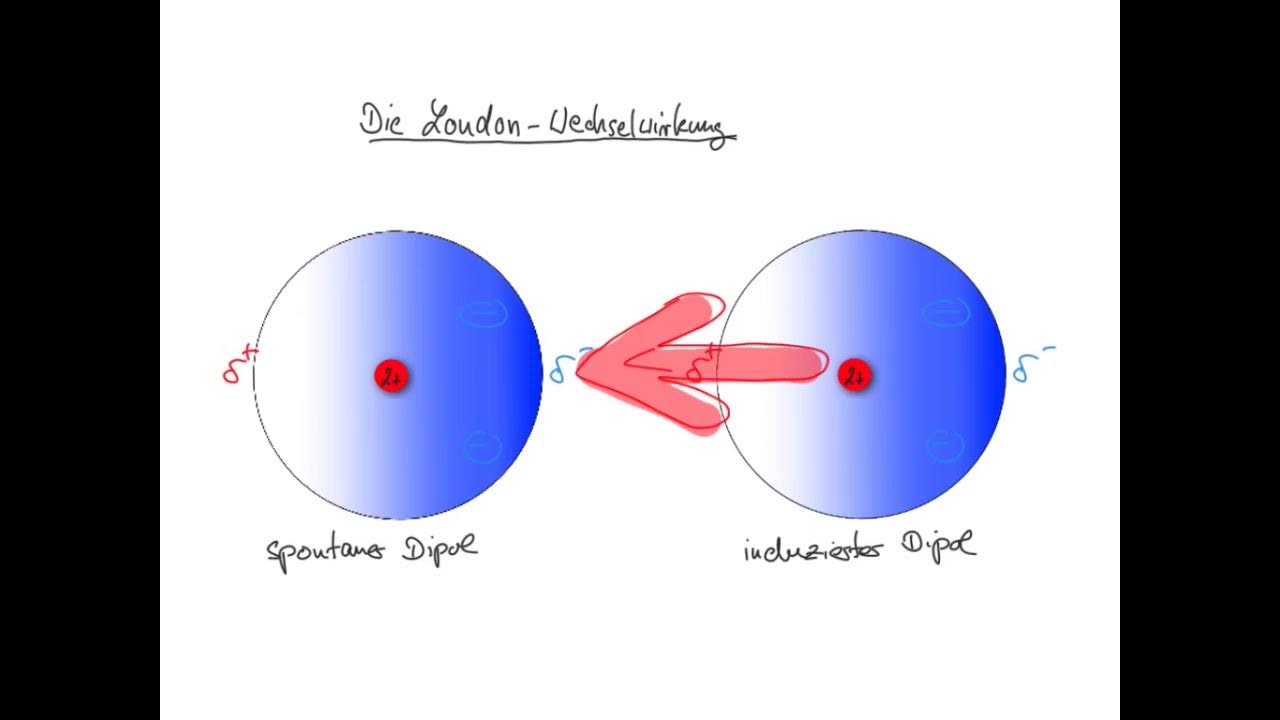
Die London Wechselwirkung

Hertzscher Dipol – Wie funktioniert eine Antenne?
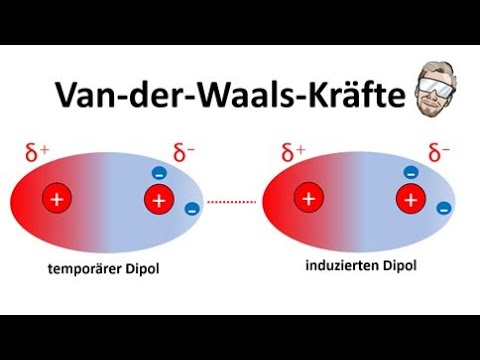
Van der Waals Kräfte | Einfluss auf die Siedetemperatur | Chemie Endlich Verstehen
5.0 / 5 (0 votes)
