TERMINOS BÁSICOS de TERMOQUÍMICA (Bloopers al final) | Termodinámica
Summary
TLDREn este video, Yamil Córdoba introduce términos fundamentales de la termoquímica, explicando la diferencia entre sistemas abiertos, cerrados y aislados. Utiliza el ejemplo del café caliente para ilustrar cómo los sistemas pueden intercambiar energía y materia. Además, define la energía como la capacidad de realizar trabajo, diferenciando entre energía cinética y potencial mediante la analogía de una pelota. Destaca la importancia de la energía térmica y la confusión común entre energía y temperatura. Finalmente, invita a los espectadores a suscribirse y apoyar el canal, agradeciendo su participación.
Takeaways
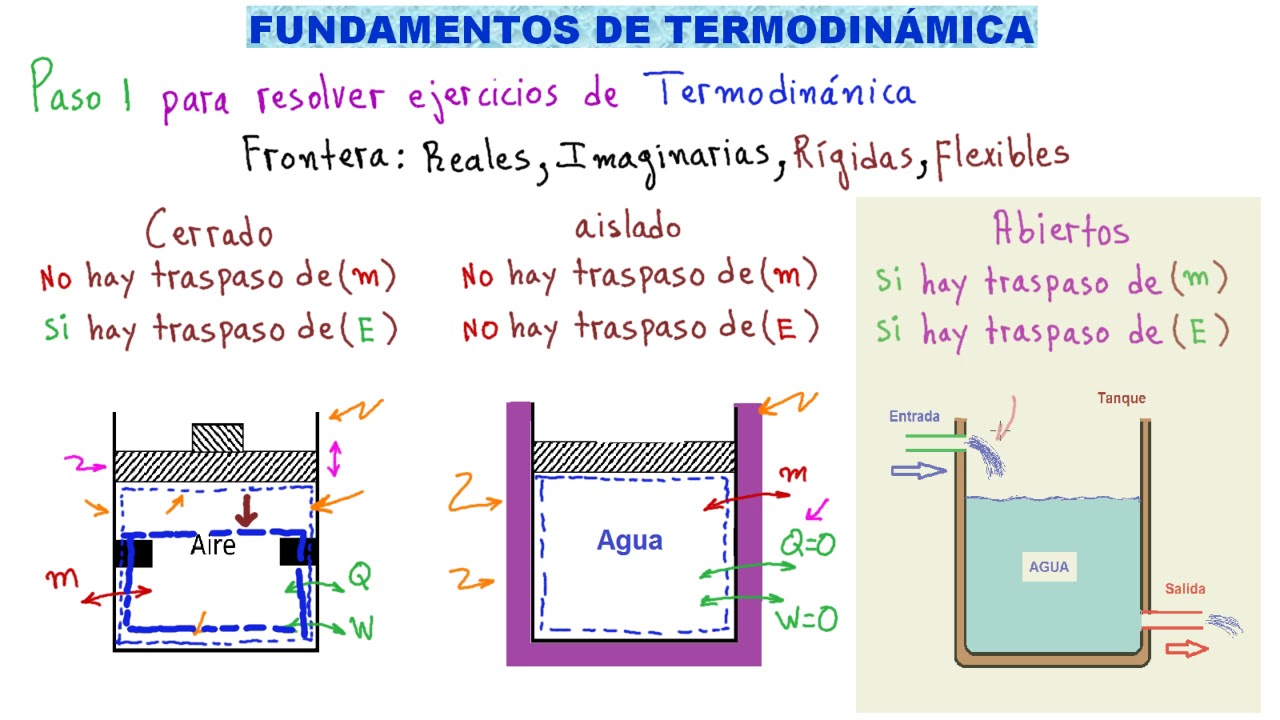
- 😀 La termodinámica se divide en sistemas y alrededores.
- 😀 Un sistema puede ser abierto, cerrado o aislado, dependiendo de sus intercambios de energía y materia.
- 😀 Un café caliente en una taza es un ejemplo de sistema abierto.
- 😀 Un café en un airlock se considera un sistema cerrado porque no intercambia materia.
- 😀 Un café en un termo sellado es un sistema aislado, ya que no intercambia ni calor ni materia.
- 😀 La energía se define como la capacidad de realizar trabajo, que se produce cuando una fuerza actúa a lo largo de una distancia.
- 😀 La energía cinética es la energía de un objeto en movimiento.
- 😀 La energía potencial es la energía almacenada que puede convertirse en energía cinética al caer.
- 😀 La energía térmica se relaciona con el movimiento aleatorio de las partículas en un objeto.
- 😀 La temperatura no es lo mismo que la energía térmica; un objeto con más partículas puede tener más energía a una temperatura más baja.
Q & A
¿Qué es un sistema en el contexto de la termoquímica?
-Un sistema es una parte del universo que se estudia en química, que puede ser tan grande como los océanos o tan pequeño como un matraz.
¿Cuáles son los tipos de sistemas que se mencionan?
-Los tipos de sistemas son: sistemas abiertos, sistemas cerrados y sistemas aislados.
¿Qué caracteriza a un sistema abierto?
-Un sistema abierto puede intercambiar tanto energía como materia con sus alrededores, como un café caliente que pierde vapor y calor.
¿Cómo se define un sistema cerrado?
-Un sistema cerrado puede intercambiar energía pero no materia, como un café en un recipiente sellado que puede enfriarse pero no pierde vapor de agua.
¿Qué es un sistema aislado?
-Un sistema aislado no puede intercambiar ni energía ni materia con su entorno, como un termo completamente sellado.
¿Qué es la energía según el vídeo?
-La energía es la capacidad de realizar un trabajo, y se puede relacionar con el movimiento de los objetos.
¿Cuál es la diferencia entre energía cinética y energía potencial?
-La energía cinética es la energía de un objeto en movimiento, mientras que la energía potencial es la energía almacenada debido a la posición de un objeto, como una pelota levantada.
¿Cómo se mide el trabajo y la energía en el Sistema Internacional?
-El trabajo y la energía se expresan en julios, que se pueden derivar de sus unidades en kilogramos, metros y segundos.
¿Qué confusión se menciona entre energía térmica y temperatura?
-Aunque la energía térmica está relacionada con la temperatura, un objeto más caliente no necesariamente tiene más energía que uno más frío si este último tiene más partículas.
¿Qué ejemplo se da para ilustrar la energía térmica?
-Se compara una taza de café caliente con una piscina a temperatura más baja, donde la piscina tiene más energía debido a la mayor cantidad de partículas.
Outlines

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنMindmap

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنKeywords

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنHighlights

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنTranscripts

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنتصفح المزيد من مقاطع الفيديو ذات الصلة
5.0 / 5 (0 votes)