Explication des spectres de raies - Physique-Chimie - 1ère S - Les Bons Profs
Summary
TLDRCette vidéo explique l'interaction entre la lumière et la matière à travers les spectres d'émission et d'absorption de l'hydrogène. Elle montre comment chaque élément chimique possède des raies spectrales uniques, servant de véritables empreintes digitales. On y décrit les processus d'obtention de ces spectres par excitation des atomes d'hydrogène et les transitions d'énergie qui se produisent, illustrées par des calculs de longueurs d'onde. Ces concepts sont essentiels pour comprendre la structure atomique et identifier les éléments à partir de leurs caractéristiques spectrales.
Takeaways
- 🌈 Le spectre d'émission de l'hydrogène présente des raies colorées sur fond noir, tandis que le spectre d'absorption montre des raies noires sur fond coloré.
- 🔍 Chaque élément chimique a une empreinte digitale unique, caractérisée par un ensemble spécifique de raies d'émission et d'absorption.
- ⚡ Pour obtenir un spectre d'émission, l'hydrogène sous basse pression est excité par une décharge électrique, provoquant l'émission de lumière.
- 📊 L'analyse de la lumière émise par l'hydrogène, à l'aide d'un prisme, permet de visualiser le spectre d'émission sur un écran.
- 💡 En spectroscopie d'absorption, de la lumière blanche est envoyée à travers l'hydrogène, et seules certaines longueurs d'onde sont absorbées.
- 🔭 Les raies d'émission et d'absorption se correspondent exactement, montrant que les éléments absorbent uniquement les radiations qu'ils peuvent émettre.
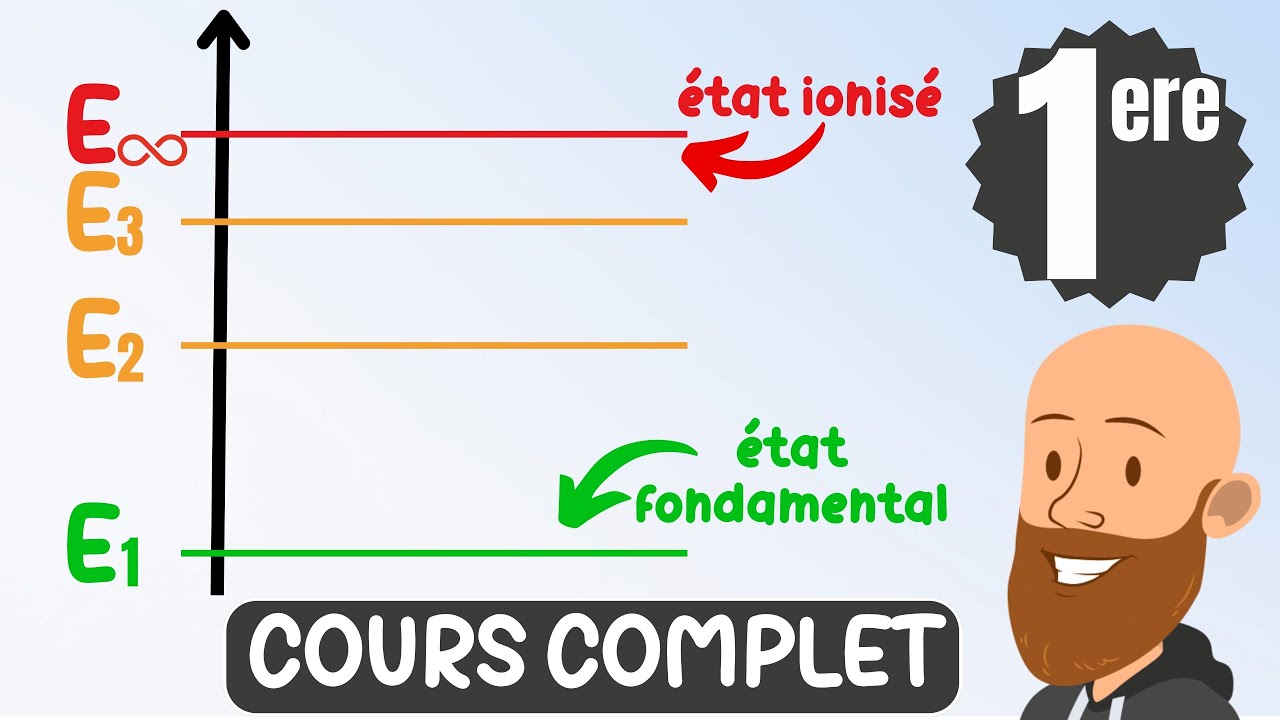
- 📏 Les transitions énergétiques dans l'hydrogène sont quantifiées, et les électrons peuvent seulement occuper certains niveaux d'énergie.
- 📉 La formule pour calculer la longueur d'onde est λ = hc/E, où h est la constante de Planck et c est la vitesse de la lumière.
- 🌌 Des transitions spécifiques à des niveaux d'énergie spécifiques entraînent l'émission ou l'absorption de photons à des longueurs d'onde déterminées.
- 🔗 Comprendre les spectres d'émission et d'absorption est essentiel en chimie et en astrophysique pour identifier des éléments dans les étoiles et autres corps célestes.
Q & A
Qu'est-ce qu'un spectre d'émission ?
-Un spectre d'émission est un graphique montrant les longueurs d'onde de la lumière émise par un élément, avec des raies colorées sur fond noir, correspondant aux photons émis lors des transitions énergétiques des atomes.
Comment obtient-on un spectre d'absorption ?
-Un spectre d'absorption est obtenu en faisant passer de la lumière blanche à travers un échantillon d'élément, qui absorbe certaines longueurs d'onde, produisant des raies noires sur un fond coloré.
Pourquoi les raies d'émission et d'absorption se correspondent-elles ?
-Les raies d'émission et d'absorption se correspondent car un élément absorbe les longueurs d'onde qu'il est capable d'émettre, créant des motifs opposés dans les deux spectres.
Quel est le rôle de la vapeur d'hydrogène dans l'obtention des spectres ?
-La vapeur d'hydrogène sous basse pression est utilisée pour observer les spectres d'émission et d'absorption, car elle permet de visualiser les transitions énergétiques de l'hydrogène.
Qu'est-ce que l'énergie quantifiée ?
-L'énergie quantifiée signifie que les atomes ne peuvent exister qu'à des niveaux d'énergie spécifiques et bien définis, plutôt que dans un continuum d'énergies.
Comment un photon est-il émis lors d'une transition énergétique ?
-Un photon est émis lorsqu'un électron d'un atome excité retourne à un état d'énergie inférieur, libérant l'énergie sous forme de lumière à une longueur d'onde spécifique.
Quelle formule est utilisée pour déterminer la longueur d'onde d'un photon émis ?
-La formule utilisée est λ = hc/E, où λ est la longueur d'onde, h est la constante de Planck, c est la vitesse de la lumière, et E est la différence d'énergie entre les états.
Pourquoi faut-il convertir les électrons-volts en joules lors des calculs ?
-Il est nécessaire de convertir les électrons-volts en joules car la formule de calcul des longueurs d'onde exige que l'énergie soit en joules.
Quels sont les différents niveaux d'énergie mentionnés dans le cas de l'hydrogène ?
-Dans le cas de l'hydrogène, les niveaux d'énergie mentionnés incluent E2, E3, E4, et E5, représentant différents états d'excitation de l'atome.
Quel est l'importance des spectres dans l'étude des éléments chimiques ?
-Les spectres d'émission et d'absorption sont essentiels pour identifier les éléments chimiques, car chaque élément a une empreinte unique de raies spectrales qui permet de les distinguer.
Outlines

此内容仅限付费用户访问。 请升级后访问。
立即升级Mindmap

此内容仅限付费用户访问。 请升级后访问。
立即升级Keywords

此内容仅限付费用户访问。 请升级后访问。
立即升级Highlights

此内容仅限付费用户访问。 请升级后访问。
立即升级Transcripts

此内容仅限付费用户访问。 请升级后访问。
立即升级浏览更多相关视频

Calculer l'énergie d'un photon ? 🎯 Exercice | 1ère | Physique

SPECTRES D’ÉMISSION 🌈 Spectres continus et spectres de raies | Lycée | Physique Chimie

Emission d'un photon - Quantification de l'énergie | Physique | Lycée
Modèles ondulatoire et particulaire de la lumière - cours de première spé de physique chimie

spectres emission Hachette

Cours : réseaux de diffraction(1) :Présentation- Formule fondamentale
5.0 / 5 (0 votes)
