Equilibrio químico
Summary
TLDREn este video, Vera, docente de bioquímica, explica el concepto de equilibrio químico. A través de ejemplos prácticos, describe cómo las reacciones químicas reversibles alcanzan el equilibrio cuando las velocidades de las reacciones directa e inversa se igualan. Además, se aborda la importancia de la constante de equilibrio y cómo varía según las concentraciones de reactivos y productos. La discusión también incluye el concepto de estado estacionario en los organismos vivos, donde las reacciones están alejadas del equilibrio, proporcionando la energía necesaria para realizar funciones biológicas. Se recomienda estudiar más a fondo los ejercicios y consultas en la plataforma EVA.
Takeaways
- 😀 Las reacciones químicas son, en su mayoría, reversibles, lo que significa que tanto la reacción directa como la inversa ocurren simultáneamente.
- 😀 La velocidad de una reacción química se refiere a la variación en la concentración de reactivos o productos con el tiempo.
- 😀 La ley de velocidad establece que la velocidad de una reacción es proporcional a la concentración de los reactivos multiplicada por una constante de velocidad.
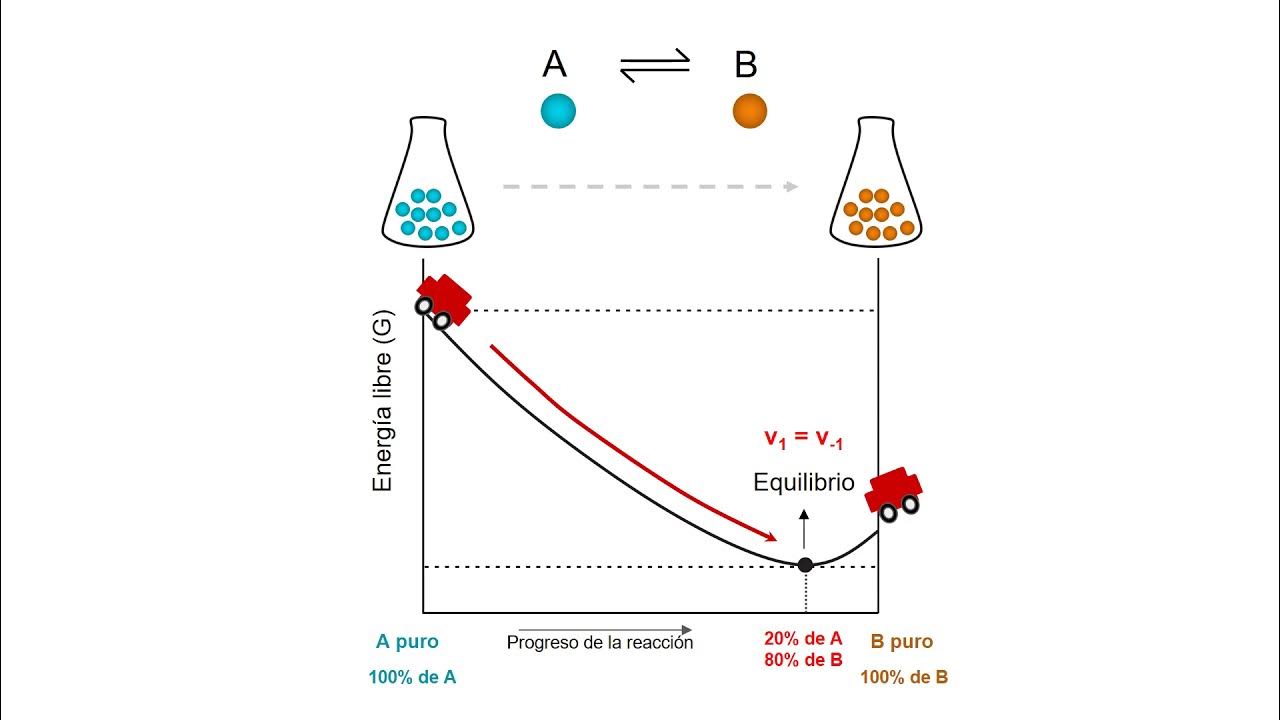
- 😀 El equilibrio químico se alcanza cuando las velocidades de las reacciones directa e inversa se igualan, lo que resulta en concentraciones constantes de reactivos y productos.
- 😀 En un equilibrio químico, las concentraciones de reactivos y productos no tienen que ser iguales, pueden variar dependiendo de la reacción.
- 😀 El equilibrio químico es dinámico, lo que significa que las moléculas de reactivos y productos siguen intercambiándose, pero las concentraciones permanecen constantes.
- 😀 El valor de la constante de equilibrio es característico de cada reacción y no cambia a una temperatura constante.
- 😀 El cociente de acción de masas nos permite determinar si una reacción está en equilibrio o si se aleja de él, y predecir hacia qué dirección se moverá.
- 😀 Si el cociente de acción de masas es mayor que la constante de equilibrio, la reacción va a favorecer la formación de productos, mientras que si es menor, se favorecerá la formación de reactivos.
- 😀 En los organismos vivos, las reacciones químicas generalmente están alejadas del equilibrio, lo que permite realizar trabajo biológico, como la regulación de la temperatura corporal o la duplicación del material genético.
Q & A
¿Qué diferencia hay entre una reacción química reversible e irreversible?
-Una reacción química reversible es aquella en la que los reactivos pueden transformarse en productos, pero también los productos pueden convertirse nuevamente en reactivos. En cambio, una reacción irreversible ocurre en una sola dirección, donde los reactivos se transforman en productos sin posibilidad de revertir el proceso.
¿Qué significa que una reacción sea reversible?
-Una reacción reversible significa que tanto la reacción directa (de reactivos a productos) como la inversa (de productos a reactivos) ocurren simultáneamente, permitiendo que los productos se conviertan nuevamente en reactivos una vez formados.
¿Cómo se define la velocidad de una reacción química?
-La velocidad de una reacción química se define como la variación en la concentración de reactivos o productos en función del tiempo. Es una medida de qué tan rápido ocurren las reacciones.
¿Qué es el equilibrio químico?
-El equilibrio químico se alcanza cuando las velocidades de las reacciones directa e inversa se igualan, lo que provoca que las concentraciones de reactivos y productos permanezcan constantes a lo largo del tiempo.
¿Por qué las concentraciones de reactivos y productos no son iguales en equilibrio?
-En equilibrio, las concentraciones de reactivos y productos no necesariamente son iguales. Esto depende de las características específicas de la reacción. Una reacción puede tener más reactivos que productos o viceversa, dependiendo de la constante de equilibrio.
¿Qué significa que el equilibrio químico sea dinámico?
-El equilibrio químico es dinámico porque, aunque las concentraciones de reactivos y productos no cambian, las reacciones directa e inversa siguen ocurriendo a la misma velocidad, lo que mantiene un balance entre las dos.
¿Cómo afecta la proporción inicial de reactivos y productos al equilibrio químico?
-Independientemente de la proporción inicial de reactivos y productos, el sistema siempre alcanzará el mismo punto de equilibrio, pero la velocidad con la que se llega al equilibrio dependerá de estas proporciones iniciales.
¿Qué es la constante de equilibrio y cómo se calcula?
-La constante de equilibrio es un valor constante para una reacción química a una temperatura dada, que relaciona las concentraciones de los productos y los reactivos en equilibrio. Se calcula como el cociente de las concentraciones de los productos elevados a sus coeficientes estequiométricos, dividido por las concentraciones de los reactivos elevados a sus coeficientes estequiométricos.
¿Qué indica una constante de equilibrio mayor que 1?
-Cuando la constante de equilibrio es mayor que 1, indica que en el equilibrio predominan los productos, ya que su concentración es mayor que la de los reactivos.
¿Qué es el cociente de acción de masas y cómo se utiliza?
-El cociente de acción de masas tiene la misma fórmula que la constante de equilibrio, pero en lugar de usar concentraciones en equilibrio, utiliza las concentraciones actuales de reactivos y productos. Comparando este valor con la constante de equilibrio, se puede determinar si una reacción está en equilibrio o si debe desplazarse hacia los productos o reactivos para alcanzar el equilibrio.
Outlines

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowMindmap

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowKeywords

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowHighlights

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowTranscripts

This section is available to paid users only. Please upgrade to access this part.
Upgrade Now5.0 / 5 (0 votes)