¿Qué son los isótopos y qué se puede hacer con ellos?
Summary
TLDRLos isótopos son versiones de un elemento químico que difieren en el número de neutrones en su núcleo. Aunque el carbono siempre tiene seis protones, el número de neutrones puede variar, creando isótopos como el carbono-12 y el carbono-14. Hay más de 3.300 isótopos conocidos en total. Estos isótopos tienen aplicaciones en investigaciones científicas variadas. Por ejemplo, en la climatología, el oxígeno tiene isótopos ligeros y pesados que se acumulan en diferentes proporciones en el hielo polar dependiendo de las condiciones climáticas pasadas. Esto permite a los científicos reconstruir el clima de épocas antiguas. Además, el carbono-14, un isótopo radiactivo, es esencial en la arqueología para datar restos fósiles y objetos antiguos, proporcionando una ventana a nuestro pasado. Los isótopos son una herramienta valiosa para entender los procesos naturales y la historia de nuestro mundo.
Takeaways
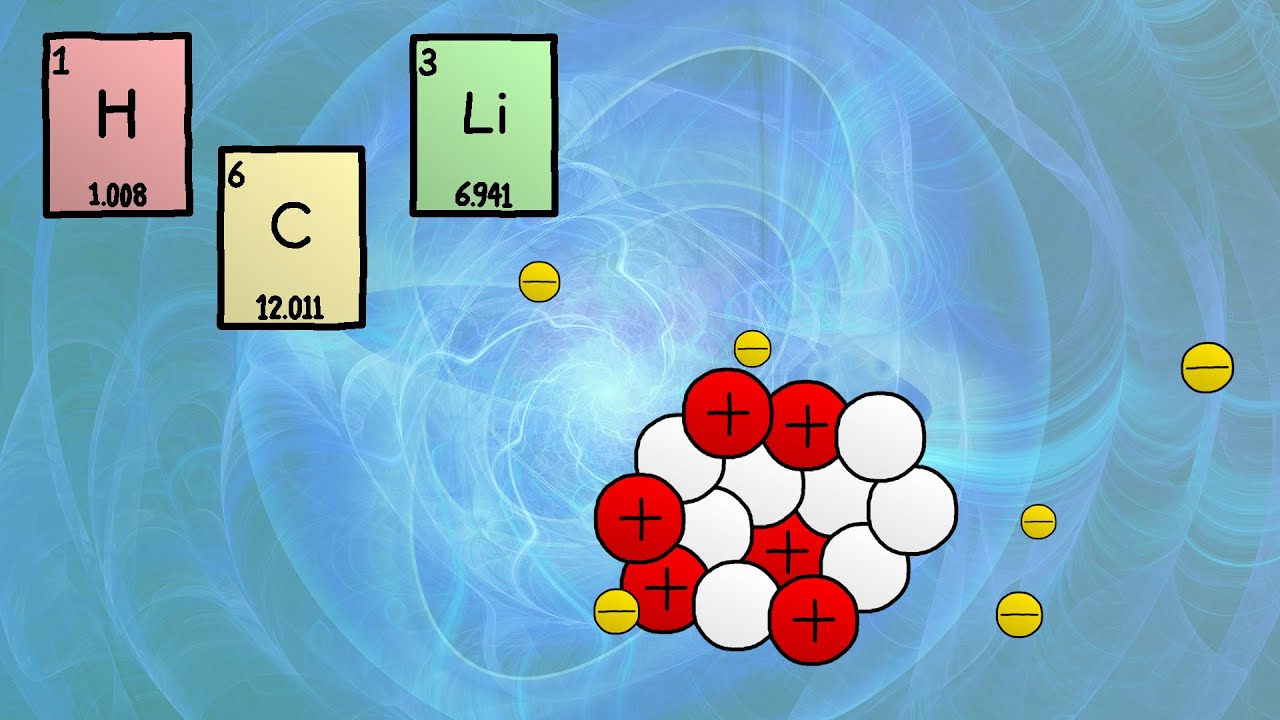
- 🌐 Los isótopos son versiones de un elemento químico que tienen un mismo número de protones pero un número diferente de neutrones.
- 🧬 Los átomos están compuestos por protones, neutrones y electrones, donde los protones y neutrones forman el núcleo.
- 💫 Un ejemplo de isótopo es el carbono, que puede tener diferentes cantidades de neutrones, como el carbono-12 y el carbono-14.
- 🌡️ Los isótopos son importantes para la investigación climática, ya que la proporción de isótopos ligeros y pesados en el oxígeno puede indicar condiciones climáticas pasadas.
- ❄️ Los hielos polares almacenan isótopos de oxígeno, cuya proporción varía según las condiciones climáticas de la época en que se formó el hielo.
- 🌞 Durante periodos cálidos, los isótopos pesados de oxígeno se evaporan más rápidamente y entran en la atmósfera.
- ❄️ En periodos fríos, los isótopos ligeros de oxígeno tienden a acumularse en el hielo.
- 🕰️ Los isótopos también funcionan como un tipo de reloj para la arqueología, permitiendo datar objetos y restos.
- 🍃 El carbono-14 es un isótopo radioactivo que se ingiere a través de los alimentos y se usa para datar restos arqueológicos.
- 🔬 La proporción de carbono-14 a carbono-12 en un objeto puede ayudar a determinar su edad aproximada.
- ⚖️ El peso de un isótopo es influenciado por la cantidad de neutrones que tiene, y esto puede ser útil para aplicaciones específicas en la ciencia.
- 🌿 La mayoría de los oxígeno en la naturaleza es el isótopo más ligero, mientras que el isótopo más pesado está presente en una proporción muy pequeña.
Q & A
¿Qué son los isótopos y cómo se relacionan con los átomos?
-Los isótopos son versiones de un elemento químico que tienen el mismo número de protones pero un número diferente de neutrones. Esto significa que todos los isótopos de un elemento tienen el mismo número de protones pero pueden variar en su número de neutrones, lo que afecta su peso atómico.
¿Por qué el número de neutrones en un isótopo afecta su peso?
-El número de neutrones afecta el peso de un isótopo porque los neutrones tienen una masa similar a la de los protones, pero son neutrales. A mayor número de neutrones en el núcleo atómico, mayor será el peso del isótopo.
¿Cuál es la relación entre los isótopos y la investigación climática?
-Los isótopos se utilizan en la investigación climática para reconstruir el clima de épocas pasadas. La proporción de isótopos ligeros y pesados de elementos como el oxígeno almacenados en los cielos polares puede indicar condiciones climáticas anteriores.
¿Cómo varía la proporción de isótopos de oxígeno en el hielo en periodos cálidos y fríos?
-En periodos cálidos, las moléculas de agua con isótopo de oxígeno pesado evaporan más lentamente y se condensan más rápidamente, lo que lleva a una mayor presencia de isótopos pesados en la atmósfera. En contraste, en periodos fríos, los isótopos ligeros de oxígeno se acumulan en el hielo.
¿Cómo los isótopos pueden actuar como un 'reloj' para la arqueología?
-Algunos isótopos son radioactivos y se desintegran con el tiempo en isótopos más estables. El carbono-14, por ejemplo, es un isótopo radioactivo que se usa en la datación de muestras arqueológicas mediante la técnica de datación por carbono-14.
¿Cómo se relaciona el carbono-14 con el carbono-12 y qué importancia tiene en la arqueología?
-El carbono-14 es un isótopo radioactivo que se ingiere a través de los alimentos en una proporción determinada con el carbono-12, un isótopo estable. La proporción de estos dos isótopos en una muestra orgánica puede usarse para determinar su edad aproximada, lo que es esencial en la arqueología para datar restos fósiles y artefactos.
¿Cuál es el número de neutrones en el núcleo del carbono y cómo afecta esto a la formación de isótopos?
-El carbono siempre tiene seis protones en su núcleo. Los neutrones pueden variar, y si el número de neutrones es diferente al número de protones, se forma un isótopo del carbono. Por ejemplo, el carbono-12 tiene seis neutrones, mientras que el carbono-14 tiene ocho neutrones.
¿Por qué los isótopos pesados de oxígeno se evaporan más lentamente y se condensan más rápidamente en periodos cálidos?
-Los isótopos pesados tienen una mayor masa, lo que les hace requerir más energía para cambiar de estado. En condiciones cálidos, la energía térmica disponible es suficiente para que los isótopos pesados se evaporen, pero en condiciones frías, son los isótopos ligeros los que se evaporan más fácilmente.
¿Cuál es el porcentaje aproximado de oxígeno compuesto por el isótopo más pesado en la naturaleza?
-El isótopo más pesado del oxígeno, con 10 neutrones, corresponde aproximadamente al 0,2% del oxígeno en la naturaleza.
¿Cómo los isótopos pueden ayudar en la determinación de la edad de una persona fallecida?
-A través de la proporción de isótopos estables y radioactivos en los restos, como el carbono-14 y el carbono-12, los científicos pueden calcular la edad de una persona fallecida. Esto se hace analizando la cantidad de desintegración del isótopo radioactivo en relación con el isótopo estable.
¿Cuál es el total aproximado de isótopos conocidos para todos los elementos químicos?
-Para todos los elementos químicos se conocen aproximadamente 3.300 isótopos.
¿Cómo los isótopos varían en términos de estabilidad y vida útil?
-Los isótopos varían en su estabilidad nuclear. Algunos isótopos son estables y no se desintegran, mientras que otros son radioactivos y tienen una vida útil finita, desintegrándose con el tiempo en otros elementos o isótopos.
Outlines

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowMindmap

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowKeywords

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowHighlights

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowTranscripts

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowBrowse More Related Video

Isótopos, número de masa, número atómico, protones, electrones, neutrones, tabla de isótopos
ISÓTOPOS y ELEMENTOS QUÍMICOS ¿Cuál es la diferencia? - Definiciones

ISÓTOPOS ⚛️ Qué son, Tipos y Ejemplos

QUE ES UN ISOTOPO

1.5 Número atómico, número de masa e isótopos

Número atómico, número de masa e isótopos
5.0 / 5 (0 votes)
