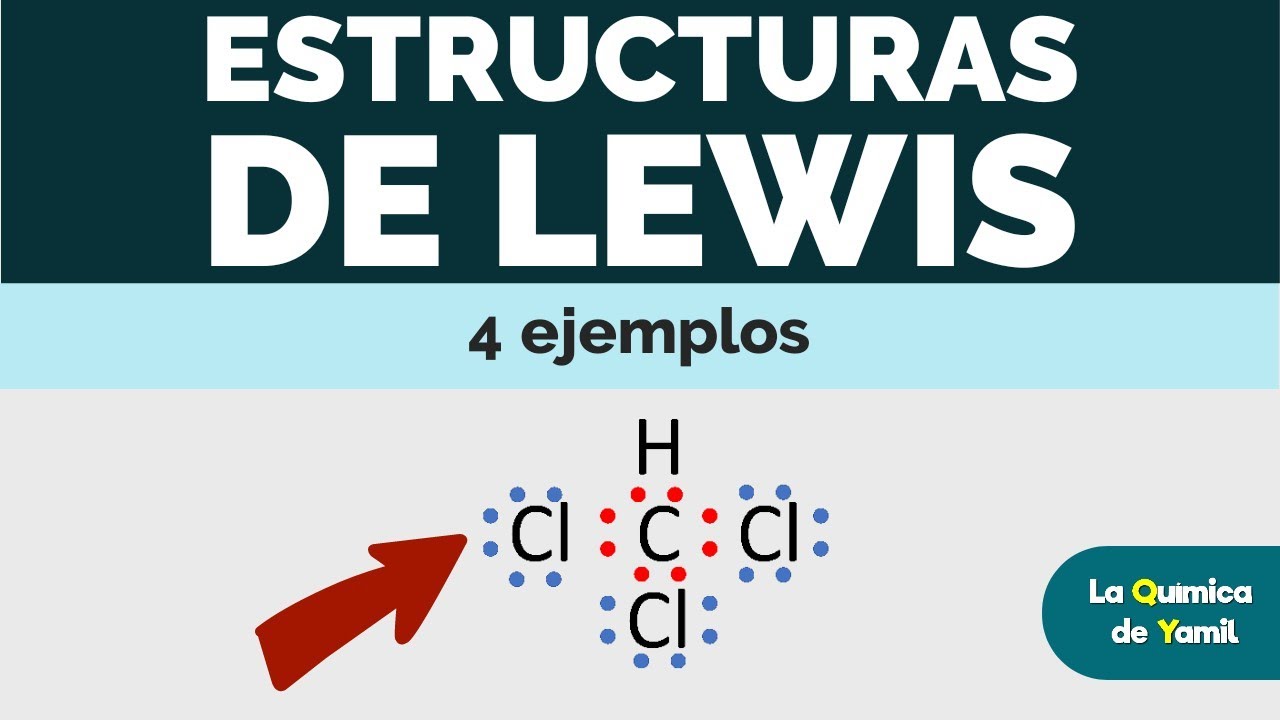
Estructura de puntos de Lewis 1: enlaces simples
Summary
TLDREl script del video ofrece una explicación detallada de cómo dibujar estructuras de puntos de Lewis para moléculas orgánicas simples, como el metano (CH4), el etano (C2H6) y el metanol (CH3OH). Seguidamente, se utiliza la tabla periódica para identificar los electrones de valencia de los átomos involucrados y se conectan formando enlaces covalentes simples. El proceso resalta la importancia de cumplir con la 'regla del octeto' para alcanzar la estabilidad, explicando cómo los átomos alcanzan la configuración electrónica de un gas noble, llenando sus orbitales y estabilizando la molécula.
Takeaways
- 📐 El video explica cómo dibujar estructuras de puntos de Lewis para moléculas orgánicas simples con enlaces covalentes simples.
- 🔬 El carbono (C) en la fórmula molecular CH4 tiene cuatro electrones de valencia, formando cuatro enlaces covalentes simples con los átomos de hidrógeno (H).
- 🧪 Los electrones de valencia son los que están en los niveles de energía más altos de un átomo.
- 📊 El carbono es estable cuando está rodeado por ocho electrones de valencia, lo que imita la configuración electrónica de un gas noble.
- 🟢 El hidrógeno tiene un electrón de valencia y se vuelve estable con dos electrones, llenando su único orbital s.
- 🧬 En una estructura con nitrógeno (N), este tiene cinco electrones de valencia y forma enlaces con los átomos de hidrógeno para cumplir la regla del octeto.
- 🌡️ El oxígeno (O) tiene seis electrones de valencia y forma enlaces con carbono e hidrógeno en moléculas como el metanol (CH3OH).
- 🔗 El metanol tiene una estructura en la que el carbono forma un enlace con el oxígeno, que a su vez se enlaza con un hidrógeno.
- 🧱 En el etano (C2H6), los dos carbonos están enlazados entre sí, cada uno formando tres enlaces con átomos de hidrógeno.
- 🧩 La regla del octeto se verifica en cada estructura de puntos de Lewis, asegurando que los átomos tengan una configuración estable con ocho electrones de valencia alrededor de ellos.
Q & A
¿Cómo se determina la posición del carbono en la tabla periódica orgánica para dibujar su estructura de puntos de Lewis?
-El carbono está en el grupo cuatro de la tabla periódica, lo que indica que tiene cuatro electrones de valencia, y por lo tanto, forma cuatro enlaces.
¿Cuál es la relación entre los electrones de valencia y los niveles de energía en un átomo de carbono?
-Los electrones de valencia están en los niveles de energía más altos o en los niveles de energía exterior, lo que significa que están disponibles para formar enlaces químicos.
¿Por qué es estable un átomo de carbono rodeado por ocho electrones de valencia?
-Cuando el carbono tiene ocho electrones de valencia a su alrededor, alcanza una configuración electrónica similar a la de un gas noble, lo que le proporciona estabilidad.
¿Cómo se determina el número de electrones de valencia que tiene el hidrógeno según la tabla periódica?
-El hidrógeno está en el grupo uno de la tabla periódica, lo que significa que tiene exactamente un electrón de valencia.
¿Cómo se forma un enlace covalente simple entre dos átomos distintos?
-Un enlace covalente simple se forma cuando dos electrones de valencia de dos átomos distintos se comparten mutuamente.
¿Por qué es importante verificar la regla del octeto al dibujar estructuras de puntos de Lewis?
-La regla del octeto asegura que los átomos tengan estabilidad, ya que se basan en tener ocho electrones de valencia a su alrededor, similar a la configuración de un gas noble.
¿Cómo se determina la ubicación de los electrones de valencia en un átomo de nitrógeno para dibujar su estructura de puntos de Lewis?
-El nitrógeno tiene cinco electrones de valencia, y se ubican en diferentes niveles de energía exterior para formar enlaces covalentes y alcanzar estabilidad.
¿Cómo se dibuja la estructura de puntos de Lewis del metanol (CH3OH)?
-Se inicia con el carbono, se añaden tres hidrógenos y luego se agrega el oxígeno, asegurándose de que cada átomo cumpla con la regla del octeto y se formen los enlaces covalentes adecuados.
¿Cuál es la configuración electrónica ideal para un átomo de oxígeno según la tabla periódica?
-El oxígeno tiene seis electrones de valencia y alcanza estabilidad cuando tiene ocho electrones de valencia a su alrededor, similar a la configuración de un gas noble.
¿Cómo se dibuja la estructura de puntos de Lewis del etano (C2H6) y cómo se verifica su corrección?
-Se dibujan dos átomos de carbono enlazados y se añaden tres hidrógenos a cada uno. Se verifica que la estructura cumpla con la regla del octeto y que el número de electrones de valencia en la estructura coincida con el número total de electrones de valencia disponibles.
Outlines

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowMindmap

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowKeywords

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowHighlights

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowTranscripts

This section is available to paid users only. Please upgrade to access this part.
Upgrade Now5.0 / 5 (0 votes)