Wechselwirkungen zwischen Molekülen/ intermolekulare Wechselwirkungen
Summary
TLDRIn diesem Video werden die verschiedenen Arten von Wechselwirkungen zwischen Molekülen erläutert. Es wird erklärt, was Moleküle zusammenhält und warum es verschiedene Aggregatzustände gibt. Der Fokus liegt auf den drei Hauptarten der Wechselwirkung: Dipol-Dipol-Wechselwirkungen, Van-der-Waals-Kräfte und Wasserstoffbrückenbindungen. Dabei werden die elektrostatischen Kräfte, die Entstehung von Dipolen und die Auswirkungen der Elektronegativität in Molekülen behandelt. Das Video geht auch auf die Bedeutung dieser Wechselwirkungen für die Aggregatzustände von Stoffen und ihre physikalischen Eigenschaften, wie Schmelz- und Siedepunkte, ein.
Takeaways
- 😀 Moleküle halten zusammen durch verschiedene Wechselwirkungen, die zwischen den Molekülen selbst bestehen, nicht zwischen den Atomen eines Moleküls.
- 😀 Es gibt verschiedene Aggregatzustände (fest, flüssig, gasförmig), die durch die Stärke der Wechselwirkungen zwischen Molekülen bestimmt werden.
- 😀 Eine wichtige Wechselwirkung ist die Dipol-Dipol-Wechselwirkung, bei der sich positive und negative Ladungsschwerpunkte anziehen.
- 😀 Dipol-Dipol-Wechselwirkungen entstehen, wenn ein Molekül eine permanente Polarität hat, z. B. aufgrund unterschiedlicher Elektronegativitäten der Bindungspartner.
- 😀 Ein Molekül wie Ammoniak hat ein permanentes Dipolmoment, weil der Stickstoff stärker elektronegativ ist und freie Elektronenpaare vorhanden sind.
- 😀 Es gibt Moleküle wie Methan, bei denen die Dipolmomente sich aufgrund der Symmetrie der Molekülstruktur gegenseitig aufheben, wodurch kein permanentes Dipolmoment existiert.
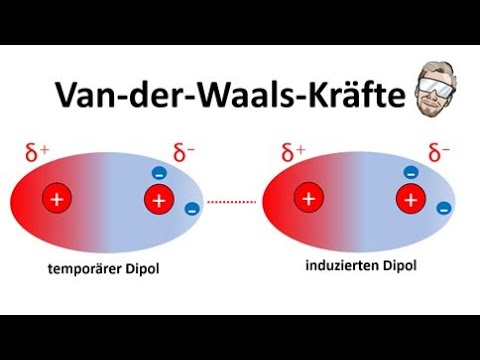
- 😀 Van-der-Waals-Kräfte sind schwache Wechselwirkungen, die durch momentane oder induzierte Dipole entstehen, die durch die Bewegung von Elektronen verursacht werden.
- 😀 Momentane Dipole entstehen durch die zufällige Bewegung von Elektronen, die bei benachbarten Molekülen induzierte Dipole hervorrufen.
- 😀 Wasserstoffbrückenbindungen entstehen zwischen Molekülen, bei denen ein Wasserstoffatom an ein sehr elektronegatives Atom (z. B. Fluor, Sauerstoff oder Stickstoff) gebunden ist.
- 😀 Wasserstoffbrückenbindungen sind verantwortlich für hohe Siedepunkte und Schmelzpunkte in Stoffen wie Wasser und Alkohol, da sie starke intermolekulare Wechselwirkungen erzeugen.
Q & A
Was ist das Hauptthema des Videos?
-Das Hauptthema des Videos sind die Wechselwirkungen zwischen Molekülen, insbesondere die Kräfte, die Moleküle zusammenhalten und die verschiedenen Aggregatzustände von Stoffen erklären.
Was sind Dipol-Dipol-Wechselwirkungen?
-Dipol-Dipol-Wechselwirkungen sind elektrostatische Kräfte zwischen Molekülen, die permanente Dipole aufweisen, d.h. ein Molekül hat einen positiven und einen negativen Pol aufgrund unterschiedlicher Elektronegativitäten der Atome in der Bindung.
Was ist ein permanentes Dipolmoment?
-Ein permanentes Dipolmoment ist eine dauerhafte elektrische Polarisation innerhalb eines Moleküls, die entsteht, wenn ein Atom in einer chemischen Bindung die Elektronen stärker anzieht als das andere, was zu einer positiven und einer negativen Teilladung führt.
Warum sind Moleküle in einem festen Zustand meist gut organisiert?
-In einem festen Zustand neigen Moleküle dazu, sich so zu orientieren, dass die positiven und negativen Teilladungen abwechseln, was den energetisch günstigsten Zustand darstellt und durch Dipol-Dipol-Wechselwirkungen stabilisiert wird.
Was sind Van-der-Waals-Wechselwirkungen?
-Van-der-Waals-Wechselwirkungen sind schwache Kräfte, die zwischen allen Molekülen und Atomen wirken, verursacht durch momentane oder induzierte Dipole. Diese Kräfte entstehen durch die zufällige Bewegung von Elektronen, die zu temporären Ladungsverschiebungen führen.
Wie unterscheiden sich Van-der-Waals-Wechselwirkungen von Dipol-Dipol-Wechselwirkungen?
-Der Hauptunterschied liegt darin, dass Dipol-Dipol-Wechselwirkungen zwischen Molekülen mit permanenten Dipolen auftreten, während Van-der-Waals-Wechselwirkungen auch in Molekülen ohne permanente Dipole existieren, basierend auf momentanen oder induzierten Dipolen.
Was sind Wasserstoffbrückenbindungen?
-Wasserstoffbrückenbindungen sind eine besondere Art der Dipol-Dipol-Wechselwirkung, die zwischen einem Wasserstoffatom, das an ein stark elektronegatives Atom wie Fluor, Sauerstoff oder Stickstoff gebunden ist, und einem freien Elektronenpaar eines anderen Atoms entsteht.
Warum haben Wasserstoffbrückenbindungen Einfluss auf die Siedepunkte von Stoffen?
-Wasserstoffbrückenbindungen führen zu stärkeren Wechselwirkungen zwischen Molekülen, was die Anziehungskraft zwischen ihnen verstärkt. Daher haben Stoffe mit Wasserstoffbrückenbindungen oft höhere Siedepunkte als vergleichbare Stoffe ohne diese Bindungen.
Warum hat Wasser trotz seiner geringen Molekülmasse einen hohen Siedepunkt?
-Wasser hat einen hohen Siedepunkt aufgrund der Wasserstoffbrückenbindungen zwischen den Molekülen. Diese Bindungen sind stark und erfordern mehr Energie, um die Moleküle voneinander zu trennen, was den hohen Siedepunkt erklärt.
Welche Elemente sind für die Bildung von Wasserstoffbrückenbindungen erforderlich?
-Für die Bildung von Wasserstoffbrückenbindungen sind ein stark elektronegatives Element wie Fluor, Sauerstoff oder Stickstoff und ein Wasserstoffatom notwendig, das an eines dieser Elemente gebunden ist.
Outlines

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantMindmap

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantKeywords

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantHighlights

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantTranscripts

Cette section est réservée aux utilisateurs payants. Améliorez votre compte pour accéder à cette section.
Améliorer maintenantVoir Plus de Vidéos Connexes

Dipole und ihre Wechselwirkungen

Einfach erklärt: London-Disperions- Dipol-Dipol- H-Brücken-Wechselwirkungen 4k 60Fps

Contract Law 60 IV Warranties and Representations of Fact
Van der Waals Kräfte | Einfluss auf die Siedetemperatur | Chemie Endlich Verstehen

Comunicación intercelular endócrina. Cátedra de Fisiología Humana, FCM UNR Argentina

Elektromagnetisches Spektrum (einfach und anschaulich erklärt)
5.0 / 5 (0 votes)
