🔀CONVERSIÓN de unidades: método del FACTOR UNITARIO🔢 o análisis dimensional
Summary
TLDREste video ofrece un método sencillo y efectivo para realizar conversiones de unidades en diversas áreas de la ciencia, como la física, química y la biología. Se basa en el uso de factores unitarios, que son conocidos por su equivalencia, como 1 kilómetro es igual a 1000 metros. El presentador explica paso a paso cómo aplicar este método en ejemplos prácticos, como convertir kilómetros por hora a metros por segundo y millas por hora a metros por segundo, así como convertir gramos a moles y átomos a gramos. El objetivo es enseñar a los espectadores cómo llegar a las unidades deseadas utilizando factores intermedios y asegurando que las unidades a eliminar estén en lados opuestos de la fracción para obtener el resultado correcto.
Takeaways
- 😀 El video presenta un método para realizar conversiones de unidades de manera rápida y sencilla.
- 🔍 Se basa en el uso de factores unitarios, que son conocidos y se refieren a la relación entre diferentes unidades.
- 📚 El método es aplicable en diversas áreas de la ciencia, incluyendo física, química y biología.
- 📝 Se ilustra el proceso con ejemplos prácticos, como la conversión de kilómetros por hora a metros por segundo.
- 🛣️ Para eliminar una unidad, se utiliza su factor unitario en forma de fracción, asegurándose de que esté en lados opuestos del numerador y denominador.
- 🔢 Es importante trabajar con los números correspondientes a cada factor unitario para llegar al resultado deseado.
- 🌐 Se pueden usar factores intermedios si el factor directo no es conocido, como convertir horas a minutos y luego a segundos.
- 📉 El resultado final es la simplificación de la expresión, obteniendo la unidad buscada sin las unidades intermedias.
- 🧪 El método también se aplica en química, como la conversión de masa a moles utilizando el peso molecular.
- 🔬 Se demuestra cómo convertir átomos a moles y luego a gramos, utilizando el número de Avogadro y el peso molecular.
- 🤓 El video concluye con un desafío para que el espectador aplique el método por sí mismo en un ejemplo adicional.
Q & A
¿Qué método se explica en el video para realizar conversiones de unidades?
-El método explicado en el video es el del 'factor unitario', que se basa en utilizar factores de conversión conocidos para cambiar de una unidad a otra en diversas áreas de la ciencia.
¿Cómo se convierten 35 kilómetros por hora a metros por segundo según el método del factor unitario?
-Para convertir 35 kilómetros por hora a metros por segundo, se multiplica 35 por 1000 (para cambiar kilómetros a metros) y luego se divide entre 3600 (para cambiar horas a segundos), resultando en 9.72 metros por segundo.
¿Cuál es el factor unitario para convertir de millas a metros?
-El factor unitario para convertir de millas a metros es que una milla equivale a 1609 metros.
¿Cómo se utiliza el factor unitario para convertir 88 millas por hora a metros por segundo?
-Para convertir 88 millas por hora a metros por segundo, se multiplica 88 por 1609 (para cambiar millas a metros) y luego se divide entre 3600 (para cambiar horas a segundos), resultando en 39.33 metros por segundo.
¿Qué es un 'mol' en términos de química y cómo se relaciona con la masa de una sustancia?
-Un 'mol' es la cantidad de sustancia que contiene un número de entidades igual al número de átomos en 12 gramos de carbono-12, y su peso en gramos es igual al peso atómico o molecular de la sustancia.
¿Cómo se convierte 120 gramos de sodio a moles de sodio?
-Para convertir 120 gramos de sodio a moles, se divide la masa en gramos (120) por el peso atómico del sodio (22.98), resultando en 5.22 moles de sodio.
¿Qué significa el número de Avogadro y cómo se utiliza en la conversión de átomos a gramos?
-El número de Avogadro es aproximadamente 6.022 x 10^23, y representa el número de partículas (átomos, moléculas, etc.) en un mol de sustancia. Se utiliza para convertir la cantidad de partículas (átomos) a moles y luego a gramos multiplicando por el peso molecular de la sustancia.
¿Cómo se convierte 2 x 10^24 átomos de cloro a gramos de cloro?
-Para convertir 2 x 10^24 átomos de cloro a gramos, se dividen los átomos entre el número de Avogadro (6.022 x 10^23) para obtener moles de cloro y luego se multiplica por el peso molecular del cloro (35.45), resultando en 117.73 gramos de cloro.
¿Por qué es útil el método del factor unitario en la química y otras ciencias?
-El método del factor unitario es útil porque permite realizar conversiones de unidades de manera rápida y sencilla, lo que es esencial en campos donde se manejan diferentes escalas de medición y es necesario convertir de una a otra para comparar o calcular magnitudes.
¿Cómo se puede aplicar el método del factor unitario en problemas más complejos que involucran múltiples conversiones de unidades?
-En problemas complejos, se pueden aplicar múltiples factores unitarios secuenciales, asegurándose de que las unidades a eliminar estén en lados opuestos de la fracción (numerador o denominador) para alcanzar la unidad deseada al final de la conversión.
Outlines

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraMindmap

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraKeywords

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraHighlights

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraTranscripts

Esta sección está disponible solo para usuarios con suscripción. Por favor, mejora tu plan para acceder a esta parte.
Mejorar ahoraVer Más Videos Relacionados

🏅CONVERSION DE UNIDADES DE MEDIDA. Como convertir o pasar de una unidad de medida a otra. Fácil

MATE PARA FÍSICA CONVERSIONES

✅CONVERSIÓN de UNIDADES Físicas| 𝙈𝙚𝙟𝙤𝙧 𝙈é𝙩𝙤𝙙𝙤 😎🫵💯| FÍSICA

Tutorial uso simuladores Cloudlabs credenciales de Sofía Plus
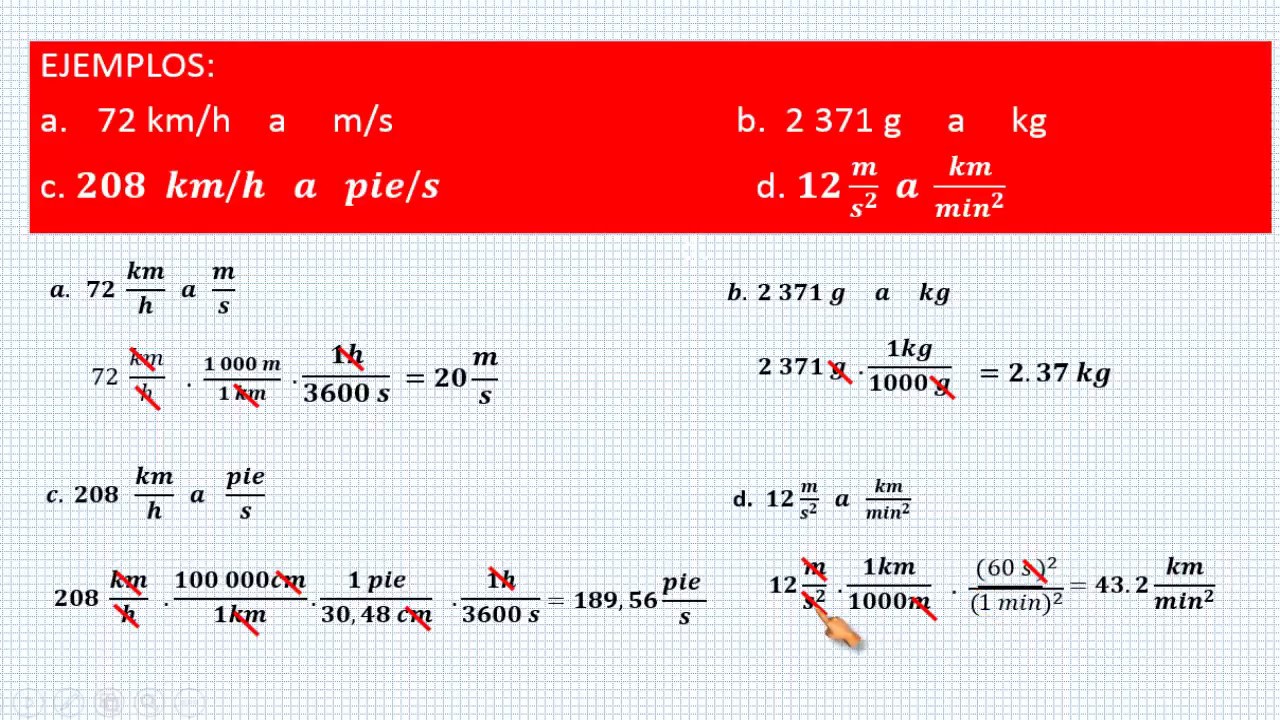
CONVERSIONES DE UNIDADES DEL SISTEMA INTERNACIONAL | EJERCICIOS

Estequiometría. Teoría 6: Esquema de Conversiones
5.0 / 5 (0 votes)