Unidad 4 Introdución Química Orgánica
Summary
TLDREste episodio de la clase de química para la facultad de ciencias agrarias se enfoca en la química orgánica, definiendo lo que son los compuestos orgánicos y sus características. Se explora el papel fundamental del átomo de carbono en la formación de una gran cantidad y variedad de compuestos, más de 13 millones, en comparación con los inorgánicos. Se destaca la habilidad del carbono para formar enlaces covalentes con una amplia gama de elementos, lo que se debe a su configuración electrónica y su capacidad para hibridación. Se describen los diferentes tipos de enlaces y la geometría asociada a las hibridaciones sp3, sp2 y sp, como se ven en moléculas como el metano, etano y benceno. Además, se mencionan las aplicaciones de los compuestos orgánicos en diversas industrias, como la alimentaria, textil, farmacéutica, petroquímica y cosmética. Finalmente, se presentan los diferentes tipos de fórmulas químicas, incluyendo la empírica, molecular, desarrollada, simplificada y semi-desarrollada, así como los conceptos de carbonos primarios, secundarios, terciarios y cuaternarios.
Takeaways
- 🌟 La química orgánica es el estudio de compuestos que contienen carbono, que son caracterizados por su gran variedad y complejidad.
- 🔍 Los compuestos orgánicos son esenciales en diversas industrias, incluyendo alimentos, textiles, farmacéutica, petroquímica y cosméticos.
- ⚛️ El átomo de carbono es fundamental en la química orgánica debido a su capacidad para formar enlaces covalentes fuertes con una amplia gama de elementos.
- 📈 La hibridación del carbono (sp, sp2, sp3) determina la geometría y tipo de enlaces que puede formar, desde simples hasta triples.
- 🔬 Los enlaces covalentes simples, dobles y triples tienen implicaciones en la estabilidad y reactividad de las moléculas orgánicas.
- 🧬 La combinación de enlaces sencillos y múltiples permite a los compuestos orgánicos formar estructuras complejas y de alto peso molecular.
- 🌐 Los compuestos orgánicos pueden ser solubles en solventes no polares y tienen bajos puntos de fusión y ebullición.
- 🔥 La combustibilidad es una propiedad común de los compuestos orgánicos, que se descomponen fácilmente formando dióxido de carbono y agua.
- 📚 La importancia de los compuestos orgánicos en la vida cotidiana es destacada por su presencia en combustibles, textiles, medicamentos, plásticos e insecticidas.
- 📊 A partir de 30 átomos de carbono y 62 de hidrógeno, se pueden formar más de 4,000 compuestos con arreglos distintos de átomos.
- 📚 La química orgánica es una disciplina especializada que requiere un conocimiento profundo de la estructura y reacciones de las moléculas orgánicas.
Q & A
¿Qué es la química orgánica?
-La química orgánica es una rama de la química que estudia los compuestos orgánicos, es decir, aquellos que contienen carbono y que suelen ser complejos y variados en estructura.
¿Por qué el carbono es capaz de formar una gran cantidad de compuestos?
-El carbono puede formar una gran cantidad de compuestos debido a su capacidad para formar enlaces covalentes fuertes con una variedad de elementos y su habilidad para unirse a sí mismo formando cadenas y anillos.
¿Cuáles son las características de los compuestos orgánicos en comparación con los inorgánicos?
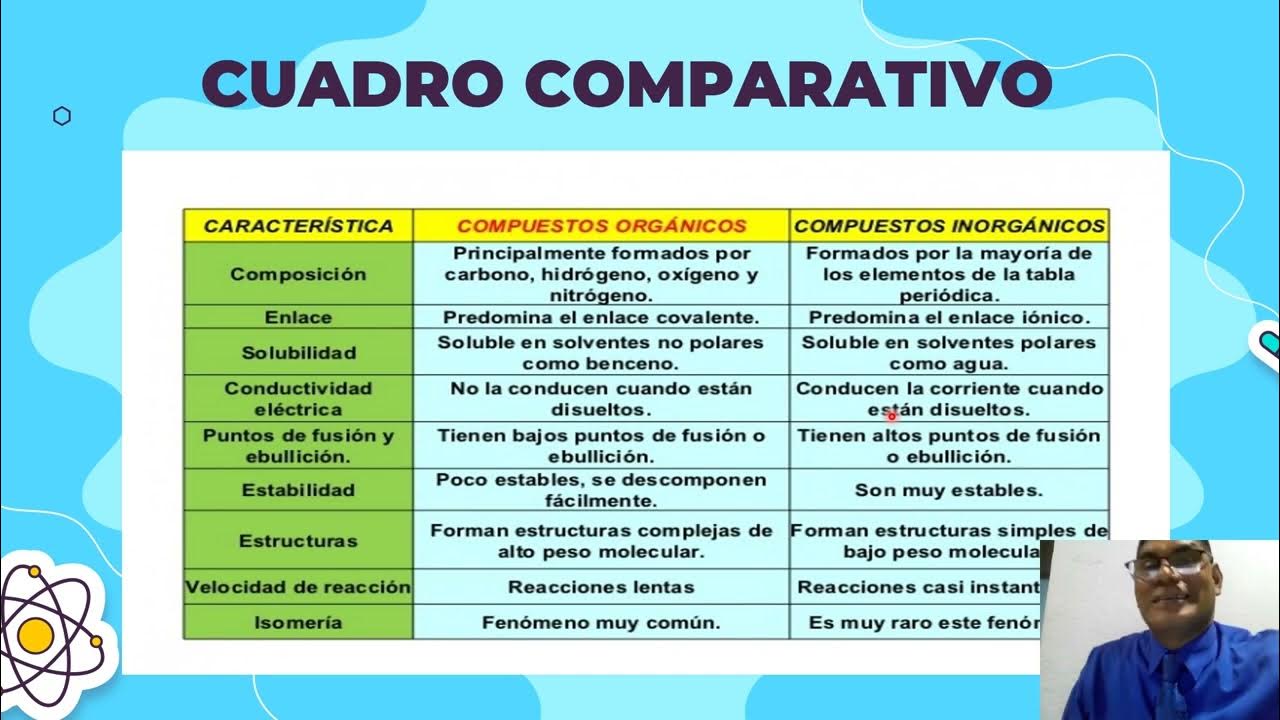
-Los compuestos orgánicos están formados principalmente por carbono, hidrógeno, oxígeno y nitrógeno, y suelen ser solubles en solventes no polares, tienen bajos puntos de fusión y ebullición, y son poco estables. Por otro lado, los compuestos inorgánicos están formados por la mayoría de los elementos de la tabla periódica, suelen ser solubles en solventes polares como el agua, conducen la corriente eléctrica y tienen altos puntos de fusión y ebullición.
¿Qué es la hibridación y cómo se relaciona con los enlaces en los compuestos orgánicos?
-La hibridación es el fenómeno que consiste en la mezcla de orbitales atómicos para generar un subconjunto de orbitales híbridos que tienen características combinadas de los orbitales originales. Esto permite a los átomos de carbono formar enlaces de diferentes tipos (simples, dobles o triples) y afecta la geometría de las moléculas orgánicas.
¿Cómo se definen los distintos tipos de carbonos en una molécula orgánica?
-Los distintos tipos de carbonos se definen en función de los enlaces que forman: un carbono primario está unido a un átomo de carbono y a tres átomos de hidrógeno, un carbono secundario está unido a dos átomos de carbono y a dos átomos de hidrógeno, un carbono terciario está unido a tres átomos de carbono, y un carbono cuaternario está unido a cuatro átomos de carbono.
¿Cómo se representa la estructura de una molécula orgánica?
-La estructura de una molécula orgánica se puede representar de varias maneras: la fórmula empírica muestra la cantidad de átomos de cada elemento, la fórmula molecular muestra la disposición exacta de los átomos, la estructura estereográfica muestra la configuración tridimensional de la molécula, y la estructura semi-desarrollada es una representación intermedia que muestra los grupos funcionales y la conectividad de los átomos de carbono.
¿Qué es la resonancia aromática y cómo se representa en los compuestos orgánicos?
-La resonancia aromática es una característica de los compuestos orgánicos en los que los electrones de los dobles enlaces están delocalizados y se distribuyen uniformemente a lo largo de un anillo de átomos de carbono. Esto se representa con una estructura en la que los dobles enlaces se alternan con los simples alrededor del anillo, indicando que la localización exacta de los dobles enlaces es una promedio de todas las posibilidades.
¿Cómo se forma un enlace triple en una molécula orgánica?
-Un enlace triple en una molécula orgánica se forma a través de la interacción frontal de dos orbitales sp y el solapamiento lateral de los orbitales p, lo que da lugar a un enlace sigma y dos enlaces pi, representados como tres enlaces entre los átomos de carbono.
¿Cuál es la importancia de los compuestos orgánicos en la industria y la vida cotidiana?
-Los compuestos orgánicos son fundamentales en la industria y la vida cotidiana, ya que están presentes en combustibles, textiles, medicamentos, plásticos, insecticidas, jabón y muchos otros productos. Su importancia radica en su diversidad y complejidad estructural, que les permite desempeñar una amplia gama de funciones y aplicaciones.
¿Cómo se definen los grupos funcionales en los compuestos orgánicos?
-Los grupos funcionales son fragmentos específicos de una molécula orgánica que incluyen un átomo de carbono y los átomos unidos a él, y que son responsables de las propiedades específicas de la molécula. Algunos ejemplos de grupos funcionales incluyen alcoholes, aldehídos, cetonas, ácidos carboxílicos y halógenos.
¿Qué es la geometría espacial de una molécula de metano y cómo se representa?
-La geometría espacial de una molécula de metano es tetraédrica, lo que significa que los cuatro átomos de hidrógeno están equidistantes y a ángulos de 109,5 grados el uno con el otro alrededor del átomo central de carbono. Esto se puede representar esquemáticamente con un tetraedro y en la estructura de Fischer con bordes sombreados y rayitas para indicar la profundidad tridimensional.
Outlines

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowMindmap

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowKeywords

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowHighlights

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowTranscripts

This section is available to paid users only. Please upgrade to access this part.
Upgrade NowBrowse More Related Video

QUIMICA ORGANICA. TIPOS DE CADENAS CARBONADAS (LINEAL, RAMIFICADA Y CICLICA) Y TIPOS DE CARBONOS.

🧪🥦QUÍMICA ORGÁNICA: Conceptos básicos🧬💊

Química 15 (CEPUSM)

Práctica: Diferencias entre los compuestos Orgánicos e Inorgánicos// FÁCIL y DIVERTIDO! ⚗️🧪🔥🚀
Clase quimica organica 1

Lecture 1| Introduction to organic chemistry| History |Vital Force Theory| What is organic chemistry
5.0 / 5 (0 votes)
