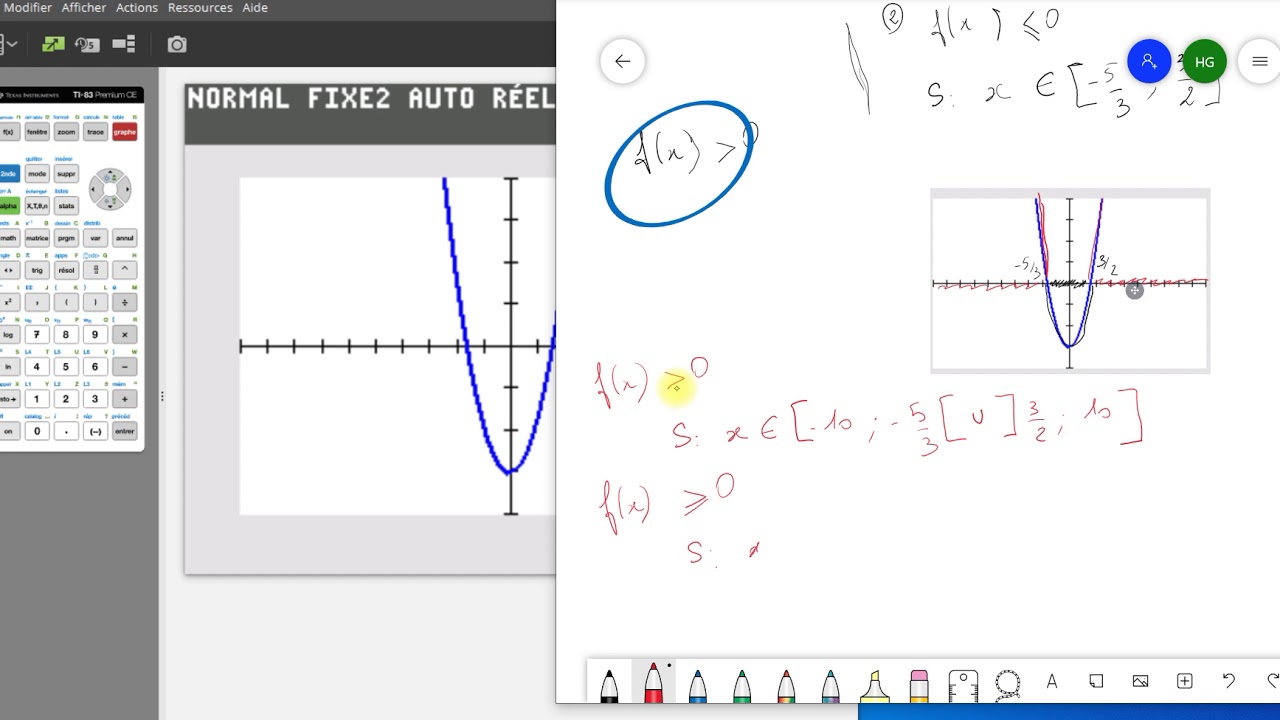
VẬT LÝ 1 - Chương 5 - Nguyên lý I nhiệt động lực học
Summary
TLDRCe script fournit une explication détaillée des principes de la thermodynamique, en mettant l'accent sur le premier principe et les différents types de processus thermodynamiques (isochorique, isobare, isotherme et adiabatique). Il couvre des calculs d'énergie interne, de travail et de chaleur dans des situations variées, notamment les changements d'état d'un gaz, la relation entre la température, le volume et la pression, ainsi que des exemples pratiques de calculs. Ce contenu est essentiel pour comprendre les lois de la thermodynamique appliquées à des systèmes réels et idéalement adaptés à une révision ou à un apprentissage approfondi de la matière.
Takeaways
- 😀 La première loi de la thermodynamique stipule que la variation d'énergie interne (ΔU) d'un système est égale à la somme du travail et de la chaleur reçus ou fournis par ce système.
- 😀 Lorsqu'un gaz passe de l'état 1 à l'état 2, la variation d'énergie interne (ΔU) est calculée en fonction de la différence entre les états 2 et 1.
- 😀 La formule de l'énergie interne pour un gaz parfait est : U = (n * y / 2) * R * T, où n est le nombre de moles, y est le coefficient adiabatique et T la température en Kelvin.
- 😀 Le travail (A) effectué pendant un processus à volume constant (isochorique) est nul car la variation de volume (dV) est zéro.
- 😀 Dans un processus à pression constante (isobare), la relation entre la température et le volume est : V / T = constante, et le travail est calculé par A = - B * (V1 - V2).
- 😀 Dans un processus isotherme, la relation PV = constante est valable, et le travail est donné par A = nRT * ln(V1 / V2).
- 😀 Pour un processus adiabatique, il existe trois relations fondamentales : PV^gamma = constante, T * V^(gamma-1) = constante et gamma = (y + 2) / y.
- 😀 La variation d'énergie interne (ΔU) pour un gaz monoatomique est calculée en utilisant ΔU = (y / 2) * n * R * (T2 - T1).
- 😀 La formule du travail dans un processus adiabatique est A = -nRT * ln(V2 / V1), où la température finale est déterminée par les relations adiabatiques.
- 😀 L'énergie interne et la chaleur d'un gaz parfait peuvent être calculées à partir de la température initiale et finale, en utilisant les formules associées aux différents types de processus thermodynamiques.
Q & A
Qu'est-ce que le premier principe de la thermodynamique et comment il est exprimé dans la vidéo ?
-Le premier principe de la thermodynamique est exprimé par la relation de variation de l'énergie interne (ΔU) qui est égale à la somme du travail (W) et de la chaleur (Q) reçue par le système. Si ΔU est positif, le système reçoit de la chaleur et du travail, tandis que si ΔU est négatif, le système produit de la chaleur et du travail.
Comment calcule-t-on l'énergie interne (U) d'un gaz idéal dans la vidéo ?
-L'énergie interne (U) d'un gaz idéal est calculée à l'aide de la formule U = n * y / 2 * R * T, où n est le nombre de moles, y est un facteur spécifique (pour les gaz monoatomiques, y = 3, et pour les gaz diatomiques, y = 5), R est la constante des gaz parfaits et T est la température.
Quel est le lien entre le travail et la chaleur dans un processus thermodynamique adiabatique ?
-Dans un processus adiabatique, la chaleur (Q) est nulle, ce qui signifie que toute l'énergie fournie ou retirée au système se manifeste sous forme de travail (W). Le travail effectué par ou sur le gaz est directement lié à la variation de l'énergie interne du système.
Qu'est-ce qu'une transformation isochore et comment cela affecte l'énergie interne ?
-Une transformation isochore se produit à volume constant, ce qui signifie que DV = 0 et donc le travail W est nul. Cependant, l'énergie interne (U) peut changer si la température du gaz varie, car ΔU = n * y / 2 * R * ΔT, où ΔT est le changement de température.
Dans un processus isotherme, quelle est la relation entre travail et chaleur ?
-Dans un processus isotherme (température constante), la variation de l'énergie interne (ΔU) est nulle, donc la chaleur (Q) reçue par le gaz est égale au travail (W) effectué par le gaz, soit Q = -W. Le travail peut être calculé par la formule W = nRT * ln(V2/V1), où V1 et V2 sont les volumes initial et final.
Comment calcule-t-on le travail dans un processus isobare ?
-Dans un processus isobare (pression constante), le travail effectué est donné par la formule W = P * (V2 - V1), où P est la pression constante et V1 et V2 sont les volumes initial et final. La chaleur reçue par le gaz peut être calculée par Q = n * Cb * ΔT, où Cb est la capacité thermique à pression constante.
Comment la loi des gaz parfaits est-elle utilisée dans le script pour déterminer l'énergie interne d'un gaz ?
-La loi des gaz parfaits PV = nRT est utilisée pour relier la pression (P), le volume (V) et la température (T) d'un gaz. En utilisant cette relation, on peut déterminer l'énergie interne en fonction de la température, car l'énergie interne est proportionnelle à la température dans un gaz idéal.
Quelles sont les différences entre les processus thermodynamiques isothermes, isobares et adiabatiques ?
-Dans un processus isotherme, la température reste constante et il y a une relation entre la chaleur et le travail, dans un processus isobare, la pression reste constante et le travail est lié à la variation de volume, et dans un processus adiabatique, il n'y a pas de transfert de chaleur, tout le changement d'énergie se fait sous forme de travail.
Que représente le paramètre gamma (γ) dans un processus adiabatique et comment est-il calculé ?
-Le paramètre gamma (γ) est le rapport des capacités thermiques à pression constante (Cp) et à volume constant (Cv), soit γ = Cp / Cv. Dans le script, γ est calculé comme étant (y + 2) / y, où y est le facteur spécifique du gaz.
Comment détermine-t-on la température finale d'un gaz dans un processus adiabatique ?
-La température finale d'un gaz dans un processus adiabatique peut être déterminée en utilisant la relation T2 / T1 = (V1 / V2)^(γ - 1), où T1 et T2 sont les températures initiale et finale, et V1 et V2 sont les volumes initial et final. Cette formule provient de la relation entre température et volume dans un processus adiabatique.
Outlines

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレードMindmap

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレードKeywords

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレードHighlights

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレードTranscripts

このセクションは有料ユーザー限定です。 アクセスするには、アップグレードをお願いします。
今すぐアップグレード5.0 / 5 (0 votes)