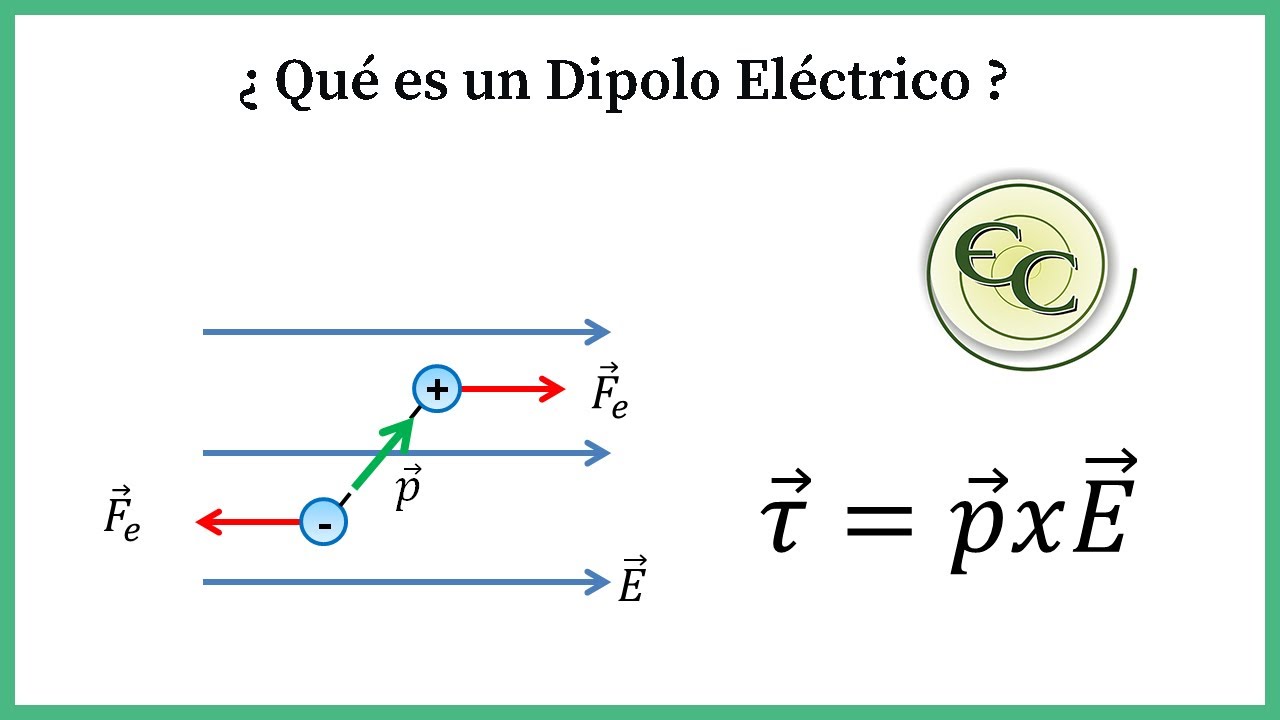
Momento dipolar
Summary
TLDREste video explica cómo analizar la polaridad de las moléculas mediante el concepto de momento dipolar. A través de ejemplos como HCl, CO2, H2O, CCl4 y CHCl3, se muestra cómo las diferencias de electronegatividad y la geometría molecular afectan la polaridad de las moléculas. Se explica cómo los enlaces covalentes polarizados pueden dar lugar a un momento dipolar en una molécula, y cómo la simetría o la falta de ella puede cancelar o mantener ese dipolo. Al final, el video destaca la importancia de entender estos conceptos para predecir la polaridad de diferentes compuestos.
Takeaways
- 😀 El momento dipolar se calcula multiplicando la magnitud de la carga (q) por la distancia entre las cargas (d).
- 😀 El ácido clorhídrico (HCl) es una molécula polar debido a que el cloro es más electronegativo que el hidrógeno, lo que genera una distribución desigual de electrones.
- 😀 En moléculas lineales como el dióxido de carbono (CO2), los momentos dipolares de los enlaces individuales se cancelan debido a la simetría, resultando en una molécula no polar.
- 😀 La molécula de agua (H2O) tiene un momento dipolar debido a su geometría angular y la diferencia de electronegatividad entre el oxígeno y el hidrógeno.
- 😀 Las moléculas con geometría simétrica como el tetracloruro de carbono (CCl4) no tienen un momento dipolar porque los vectores dipolares se cancelan entre sí.
- 😀 En moléculas como el cloroformo (CHCl3), la presencia de un hidrógeno en lugar de un cloro provoca un desequilibrio en la distribución de electrones, generando un momento dipolar.
- 😀 Los enlaces covalentes entre átomos de diferente electronegatividad crean un dipolo, como en los enlaces entre carbono y oxígeno en el dióxido de carbono (CO2).
- 😀 El momento dipolar se representa con la letra griega μ (miu) y sus unidades son el dispositivo (D).
- 😀 La molécula de agua tiene un momento dipolar de 1.85 D, lo que la convierte en una molécula polar con una distribución de electrones desigual.
- 😀 Las moléculas lineales como el dióxido de carbono (CO2) no tienen un momento dipolar debido a la cancelación de los momentos dipolares individuales en direcciones opuestas.
Q & A
¿Qué es el momento dipolar y cómo se calcula?
-El momento dipolar es una medida de la separación de cargas dentro de una molécula. Se calcula multiplicando la magnitud de la carga (q) por la distancia (d) entre las cargas, es decir, μ = q * d.
¿Qué significa que una molécula sea polarizada?
-Una molécula se considera polarizada cuando tiene una distribución desigual de electrones, lo que genera una carga parcial positiva en un extremo y una carga parcial negativa en el otro. Este fenómeno ocurre, por ejemplo, en el ácido clorhídrico (HCl).
¿Por qué el ácido clorhídrico (HCl) es una molécula polar?
-El HCl es polar debido a que el cloro es más electronegativo que el hidrógeno, lo que provoca que los electrones se desplacen hacia el cloro, generando una carga parcial negativa en el cloro y una carga parcial positiva en el hidrógeno. Esto crea un momento dipolar.
¿Cómo se analiza la polaridad en moléculas como el dióxido de carbono (CO2)?
-En el CO2, aunque los enlaces entre el carbono y el oxígeno son polares, la molécula tiene una geometría lineal. Los vectores de momento dipolar generados por cada enlace se cancelan entre sí, ya que están en direcciones opuestas, lo que hace que el CO2 no tenga un momento dipolar neto y sea una molécula no polar.
¿Por qué el dióxido de carbono no tiene un momento dipolar a pesar de tener enlaces polares?
-El dióxido de carbono tiene una geometría lineal, por lo que los momentos dipolares de los dos enlaces entre el carbono y los oxígenos se cancelan entre sí debido a que tienen la misma magnitud pero direcciones opuestas, resultando en un momento dipolar neto de cero.
¿Cuál es la diferencia en la polaridad entre el dióxido de carbono y el agua?
-A diferencia del CO2, el agua tiene una geometría angular (en forma de V). Los momentos dipolares de los enlaces O-H no se cancelan debido a la forma de la molécula, por lo que el agua tiene un momento dipolar neto y es una molécula polar.
¿Qué influencia tiene la electronegatividad en la polaridad de una molécula?
-La electronegatividad influye en la polaridad de una molécula porque los átomos más electronegativos atraen más electrones hacia sí mismos, lo que genera una distribución desigual de carga. Esto puede crear una carga parcial negativa en un átomo y una carga parcial positiva en otro, contribuyendo a la polaridad de la molécula.
¿Cómo se calcula el momento dipolar de la molécula de agua?
-El momento dipolar de la molécula de agua se calcula considerando la distribución de electrones en los enlaces O-H y las parejas solitarias de electrones en el oxígeno. El momento dipolar neto de la molécula de agua es de 1.85, apuntando hacia la parte superior de la molécula.
¿Qué ocurre con los momentos dipolares en moléculas con geometría tetraédrica como el tetracloruro de carbono (CCl4)?
-En moléculas con geometría tetraédrica, como el tetracloruro de carbono, los momentos dipolares generados por los enlaces C-Cl se cancelan entre sí debido a la simetría de la molécula. Como resultado, el tetracloruro de carbono no tiene un momento dipolar neto y es una molécula no polar.
¿Por qué el cloroformo (CHCl3) tiene un momento dipolar a pesar de tener enlaces polares similares al tetracloruro de carbono?
-El cloroformo tiene un momento dipolar porque su geometría es diferente a la del tetracloruro de carbono. En el cloroformo, la presencia de un átomo de hidrógeno en lugar de un cloro genera un desequilibrio en los momentos dipolares de los enlaces C-Cl, resultando en un momento dipolar neto de 1.01, lo que hace que la molécula sea polar.
Outlines

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنMindmap

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنKeywords

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنHighlights

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنTranscripts

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآن5.0 / 5 (0 votes)