Van der Waals Kräfte | Einfluss auf die Siedetemperatur | Chemie Endlich Verstehen
Summary
TLDRIn diesem Video wird erklärt, wie Van-der-Waals-Kräfte durch temporäre Dipole zwischen Molekülen entstehen und wie diese schwachen Wechselwirkungen die Eigenschaften von Molekülen beeinflussen. Zunächst wird die Bedeutung der Elektronegativität und die Unterschiede zwischen polaren und unpolaren Bindungen behandelt. Dann wird gezeigt, wie Van-der-Waals-Kräfte, die besonders bei langkettigen und geradlinigen Molekülen stärker sind, die Siedetemperatur von Alkanen beeinflussen. Auch die Wirkung der Molekülstruktur, wie bei verzweigten Alkanen, wird erklärt, da diese weniger Van-der-Waals-Kräfte ausbilden und eine niedrigere Siedetemperatur haben.
Takeaways
- 😀 Elektronegativität beschreibt die Fähigkeit eines Atoms, Bindungselektronen anzuziehen. Jeder Atom hat eine spezifische Elektronegativität, die im Periodensystem zu finden ist.
- 😀 Der Unterschied in der Elektronegativität zwischen zwei Atomen einer Verbindung bestimmt die Art der Bindung: Unpolar bei einem Unterschied von 0 bis 0,5, polar bei 0,5 bis 1,7 und ionisch bei über 1,7.
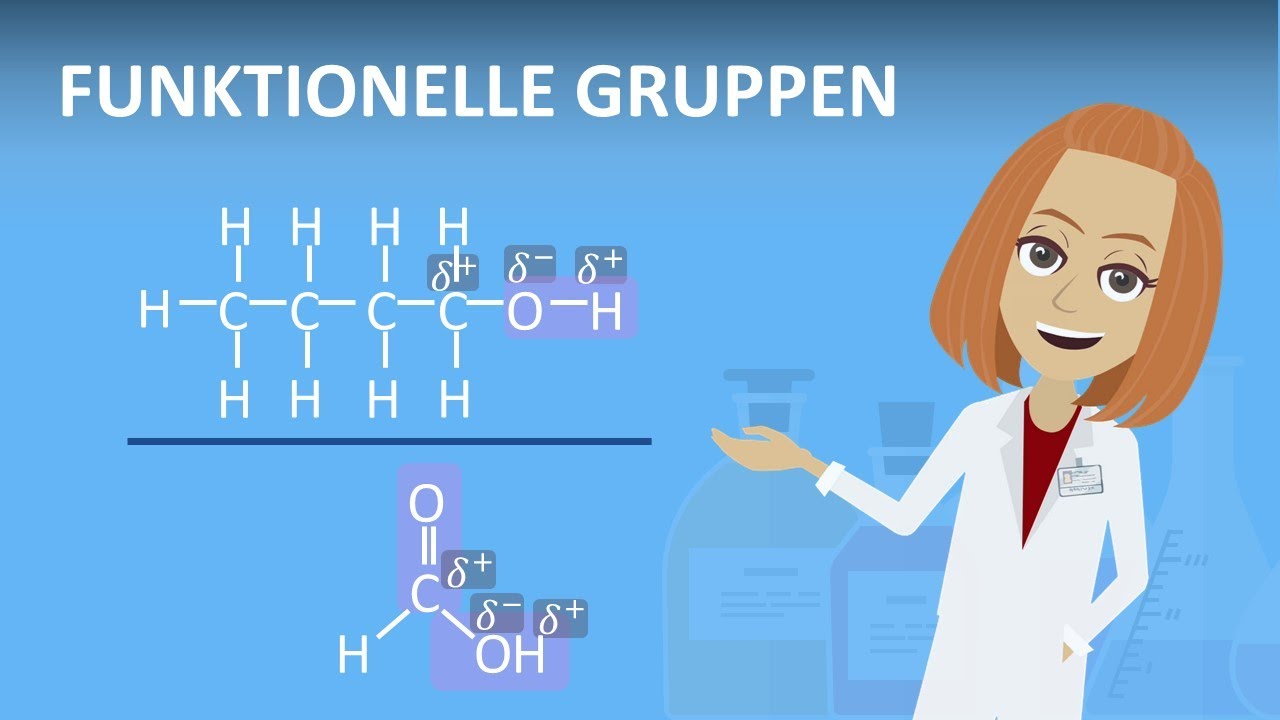
- 😀 Eine polare Elektronenpaarbindung tritt auf, wenn zwei Atome unterschiedliche Elektronegativitäten haben und es zu einer partiellen negativen und positiven Ladung kommt.
- 😀 Temporäre Dipole entstehen in unpolaren Molekülen durch zufällige Ungleichverteilungen der Elektronen, was zu kurzzeitigen partiellen Ladungen führt.
- 😀 Induzierte Dipole entstehen, wenn ein temporärer Dipol die Elektronenverteilung eines benachbarten Moleküls beeinflusst, was zu einer positiven und einer negativen partiellen Ladung führt.
- 😀 Van der Waals Kräfte sind schwache intermolekulare Kräfte, die durch temporäre und induzierte Dipole entstehen.
- 😀 Diese Van der Waals Kräfte sind schwächer als andere intermolekulare Kräfte wie Wasserstoffbrückenbindungen.
- 😀 Alkanmoleküle wie Ethane und Hexan zeigen unterschiedliche Van der Waals Kräfte, wobei längere Moleküle stärkere Wechselwirkungen aufweisen und damit höhere Siedepunkte haben.
- 😀 Ein Molekül mit einer längeren Kohlenstoffkette, wie Hexan, hat einen höheren Siedepunkt als ein kurzkettiges Molekül wie Ethan, da es mehr Van der Waals Kräfte bilden kann.
- 😀 Verzweigte Alkane haben aufgrund ihrer unregelmäßigen Struktur weniger Van der Waals Kräfte und somit niedrigere Siedepunkte im Vergleich zu unverzweigten Alkanen.
Q & A
Was versteht man unter Elektronegativität?
-Elektronegativität bezeichnet die Fähigkeit eines Atoms, die Bindungselektronen anzuziehen. Jedes Element hat einen spezifischen Elektronegativitätswert, der im Periodensystem zu finden ist.
Wie wird der Unterschied in der Elektronegativität zwischen zwei Atomen interpretiert?
-Der Unterschied in der Elektronegativität (Delta) bestimmt, ob eine Bindung unpolar oder polar ist. Ein Delta von 0 bis 0,5 führt zu einer unpolaren Bindung, ein Delta von 0,5 bis 1,7 zu einer polaren Bindung und ab einem Delta von 1,7 entsteht eine ionische Bindung.
Wie erklärt sich die Entstehung einer polaren Bindung?
-In einer polaren Bindung zieht das Elektronegativere Atom stärker an den Bindungselektronen, was zu einer partiellen negativen Ladung am Elektronegativitätsstärkeren Atom und einer partiellen positiven Ladung am anderen führt.
Warum sind in Alkanen dennoch Anziehungskräfte zwischen den Molekülen zu beobachten?
-Obwohl Alkane eine unpolare Bindung haben, kann es aufgrund zufälliger Elektronenverteilung zu temporären Dipolen kommen, die für kurzzeitige Anziehungskräfte verantwortlich sind. Diese nennen wir Van-der-Waals-Kräfte.
Was ist ein temporärer Dipol?
-Ein temporärer Dipol entsteht, wenn die Elektronen in einer Bindung aufgrund zufälliger Bewegungen kurzzeitig ungleich verteilt sind, was zu einer partiellen negativen und positiven Ladung führt.
Wie entstehen induzierte Dipole?
-Ein induzierter Dipol entsteht, wenn ein temporärer Dipol die Elektronenverteilung eines benachbarten Moleküls beeinflusst, was zu einer Verschiebung der Elektronen und damit zu einer neuen partiellen Ladung führt.
Was sind Van-der-Waals-Kräfte?
-Van-der-Waals-Kräfte sind schwache Anziehungskräfte, die durch temporäre oder induzierte Dipole zwischen Molekülen entstehen. Sie sind deutlich schwächer als kovalente Bindungen oder Wasserstoffbrücken.
Welche Rolle spielen Van-der-Waals-Kräfte bei der Schmelz- und Siedetemperatur von Alkanen?
-Alkane mit längeren Ketten können stärkere Van-der-Waals-Kräfte ausbilden, was zu höheren Schmelz- und Siedetemperaturen führt. Kurzkettige Alkane haben schwächere Van-der-Waals-Kräfte und damit niedrigere Temperaturen.
Wie beeinflusst die Molekülstruktur von Alkanen die Van-der-Waals-Kräfte?
-Geradlinige Alkane haben stärkere Van-der-Waals-Kräfte, da die Moleküle enger beieinander liegen können. Verzweigte Alkane haben aufgrund ihrer Struktur weniger Kontaktfläche und daher schwächere Van-der-Waals-Kräfte.
Warum haben verzweigte Alkane niedrigere Siedetemperaturen als gerade Alkane?
-Verzweigte Alkane können weniger Van-der-Waals-Kräfte ausbilden als gerade, langkettige Alkane, da ihre Moleküle aufgrund der Verzweigungen weniger dicht beieinander liegen. Dies führt zu einer niedrigeren Siedetemperatur.
Outlines

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنMindmap

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنKeywords

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنHighlights

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنTranscripts

هذا القسم متوفر فقط للمشتركين. يرجى الترقية للوصول إلى هذه الميزة.
قم بالترقية الآنتصفح المزيد من مقاطع الفيديو ذات الصلة

Wechselwirkungen zwischen Molekülen/ intermolekulare Wechselwirkungen

Dipole und ihre Wechselwirkungen

Einfach erklärt: London-Disperions- Dipol-Dipol- H-Brücken-Wechselwirkungen 4k 60Fps
Funktionelle Gruppen - Übersicht, Tabelle & Erklärung | Studyflix

Was sind Wasserstoffbrückenbindungen? - REMAKE

Aldehyde & Ketone (Aufbau & Eigenschaften) | Chemie Tutorial
5.0 / 5 (0 votes)
